
常温下,向20.00mL0.1000mol·L-1(NH4)2SO4溶液中逐滴加入0.2000mol·L-1NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑NH3·H2O的分解)。下列说法不正确的是

A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(NH4+)+c(H+)+ c(Na+)=c(OH-)+2c(SO42-)
D.点d所示溶液中:c(NH4+)+c(NH3·H2O)= 0.1000mol·L-1
B
【解析】
试题分析:(NH4)2SO4是强酸弱碱盐,其溶液显酸性,故点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-),A对,不选;NH4+水解是微弱的,所以溶液显中性时加入的NaOH溶液量是少量的,故c(NH4+)>c(Na+),B错,选B;c(NH4+)+c(H+)+ c(Na+)=c(OH-)+2c(SO42-)是电荷守恒,C对,不选;c(NH4+)+c(NH3·H2O)= 0.1000mol·L-1是物料守恒,D对,不选。选B。
考点:盐类水解和离子浓度的大小比较。
考点分析: 考点1:水的电离和溶液的酸碱性 考点2:盐类水解 试题属性

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年北京市海淀区高三年级3月适应性训练理综化学试卷(解析版) 题型:选择题
已知反应:2NO2(红棕色) N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是


A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)
D.d 点:v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三上学期期末考试化学试卷(解析版) 题型:填空题
(10 分)已知甲酸铜遇水易水解而具有还原性。实验室制备甲酸铜晶体[Cu(HCOO)2·4H2O]的流程如下:

回答下列问题:
(1)研磨时应该将固体原料放在(填仪器名称) 中;制备 Cu2(OH)2CO3时需要用到70℃~80℃的热水溶解小苏打和胆矾的混合物,其目的是 。
(2)写出用小苏打、胆矾制备 Cu2(OH)2CO3的离子方程式 ;实际操作中的小苏打与胆矾 的物质的量之比大于 2∶1,原因是 。
(3)操作a 的名称是 。
(4)证明Cu2(OH)2CO3沉淀已经洗涤干净的实验方法是 。
(5)实验中用无水乙醇洗涤产物的目的是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三上学期期末考试化学试卷(解析版) 题型:选择题
美日三位科学家曾因对“有机物合成过程中钯催化交叉偶联”的研究获诺贝尔化学奖。评审委员会认定这项研究成果可以大大提升合成复杂化学物质的可能性。钯的化合物氯化钯可用来检测有毒气体CO,发生反应的化学方程式为:CO+PdCl2+H2O=CO2+Pd↓+2HC1。对该反应的下列说法正确的是
A.CO作氧化剂,具有氧化性
B.HCl是还原产物
C.反应中H2O 提供了氧原子,因此 H2O 是氧化剂
D.生成22.4 L CO2(标准状况)时,转移的电子数为2 mo1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省烟台市高三下学期一模诊断测试理科综合化学试卷(解析版) 题型:填空题
(12分)【化学—物质结构与性质】
电石(CaC2)发生如下反应合成尿素[CO(NH2)2],可进一步合成三聚氰胺。

(1)CO(NH2)2分子中含有σ键的个数为______。CaCN2中阴离子为CN22-,与CN22-离子互为等电子体的分子的化学式为_______,可推知CN22-的空间构型为_________。
(2)三聚氰胺在动物体内可转化为三聚氰酸( ),三聚氰酸分子中N原子采取______杂化。三聚氰胺与三聚氰酸的分子相互之间通过________结合,在肾脏内易形成结石。
),三聚氰酸分子中N原子采取______杂化。三聚氰胺与三聚氰酸的分子相互之间通过________结合,在肾脏内易形成结石。
(3)下图是电石的晶胞示意图,则一个晶胞中含有___个Ca2+离子,研究表明,C22-的存在使晶胞呈长方体,该晶胞中一个Ca2+周围距离相等且最近的C22-有___个。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省烟台市高三下学期一模诊断测试理科综合化学试卷(解析版) 题型:选择题
下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是
X | |||
Y | Z | W | |
A.最高价氧化物对应水化物的酸性Y>Z>W
B.含Y元素的盐溶液一定显酸性
C.原子半径:rW>rZ>rY>rX
D.X与W的气态氢化物可相互反应生成离子化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省泰安市高三下学期一模理科综合化学试卷(解析版) 题型:填空题
对氮及其化合物的研究具有重要意义。
(1)在1 L密闭容器中,4 mol氨气在一定条件下分解生成氮气和氢气。2 min时反应吸收热量为46.1 kJ,此时氨气的转化率为25%。该反应的热化学方程式为_____________,这段时间内v(H2)=_________。
(2)298K时.在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g)
N2O4(g)  =-akJ·mol-1(a>0),N2O4的物质的量浓度随时间变化如图所示。达平衡时,N2O4的浓度为NO2的2倍。
=-akJ·mol-1(a>0),N2O4的物质的量浓度随时间变化如图所示。达平衡时,N2O4的浓度为NO2的2倍。

①298K时,该反应的化学平衡常数为_________(精确到0.01);
②下列情况不是处于平衡状态的是__________(填字母序号);
a.混合气体的密度保持不变
b.混合气体的颜色不再变化
c.气压恒定时
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时v正____v逆(填“>”、“<”或“=”)。
(3)用氨气可设计成如图所示燃料电池,产生的X气体可直接排放到大气中。则a电极电极反应式为________________。
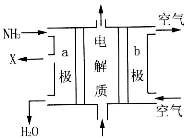
(4)t℃下,某研究人员测定NH3·H2O的电离常数为1.8×10-5。NH4+的水解常数为1.5×10-8,则该温度下水的离子积常数为___________,请判断t_____25℃(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省稳派教育高三一轮复习质量检测理科综合化学试卷(解析版) 题型:选择题
已知常温下CH3COOH的电离平衡常数为Ka ,常温下,向20mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中正确的是

A. a点表示的溶液中由水电离出的H+浓度为1.0×10-3mol·L-1
B. b点表示的溶液c(CH3COO-)< c(Na+)
C. b、d点表示的溶液中 相等
相等
D. c点表示CH3COOH和NaOH恰好反应完全
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省六校高三3月联考化学试卷(解析版) 题型:填空题
(13分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为____________________________。利用反应6NO2+8NH3 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下的体积是________L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下的体积是________L。
(2)已知:2SO2(g)+O2(g)  2SO3(g) ΔH=—196.6 kJ/mol ;
2SO3(g) ΔH=—196.6 kJ/mol ;
2NO(g)+O2(g)  2NO2(g) ΔH=—113.0 kJ/mol ;
2NO2(g) ΔH=—113.0 kJ/mol ;
①则反应NO2(g)+SO2(g)  SO3(g)+NO(g) ΔH 的ΔH=________。
SO3(g)+NO(g) ΔH 的ΔH=________。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___ _____。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1 mol SO3的同时生成1 mol NO2
③测得上述反应平衡时NO2与SO2的体积比为1∶6,则平衡常数K=__ ______。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g) ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g) ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。

该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是______________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com