
 Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等. .
. .
.分析 I.A、B、W、D、E为短周期元素,且原子序数依次增大,A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期ⅢA族元素,故E为Al元素;A、B、W、D、E五元素质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素;
Ⅱ.X、Y、Z为三种不同短周期非金属元素的单质.
(6)若常温下X、Y、Z均为气体,且A和B化合生成一种固体时的现象是有白烟,为NH3与HCl反应生成NH4Cl,A、B分别为HCl、NH3中的一种,结合转化关系可知Y为H2;
(7)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,B具有漂白性,结合转化关系可推知,Y为S、X为H2、A为H2S、Z为O2、B为SO2.
解答 解:I.A、B、W、D、E为短周期元素,且原子序数依次增大,A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期,ⅢA族元素,故E为Al元素;A、B、W、D、E五元素质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素.
(1)E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期第ⅢA族,
故答案为:第三周期第ⅢA族;
(2)由H、C、O三种元素组成的18电子微粒,该微粒中只能含有1个C原子、1个O原子,故含有H原子数目=18-6-8=4,故该微粒结构简式为CH3OH,电子式为: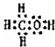 ,
,
故答案为: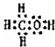 ;
;
(3)A2W2为H2O2,Cu和稀硫酸不反应,加入具有氧化性的H2O2,可生成硫酸铜和水,反应的离子方程式为Cu+2H++H2O2=Cu2++2H2O,
故答案为:Cu+2H++H2O2=Cu2++2H2O;
(4)NaH能与水反应放氢气,同时生成氢氧化钠,则:
NaH+H2O=NaOH+H2↑
1mol 1mol 1mol
2NaOH+2Al+2H2O=2NaAlO2+3H2↑
1mol 1mol 1.5mol
n(H2)=1mol+1.5mol=2.5mol,
V(H2)=2.5mol×22.4L/mol=56L,
故答案为:56L;
(5)钠的某化合物呈淡黄色,该化合物为过氧化钠,由于Na2O2和Fe2+的物质的量之比为1:2,反应没有气体生成,根据质量守恒可知生成物为Fe(OH)3、NaCl和FeCl3,反应的离子方程式为3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+,
故答案为:3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+;
Ⅱ.X、Y、Z为三种不同短周期非金属元素的单质.
(6)若常温下X、Y、Z均为气体,且A和B化合生成一种固体时的现象是有白烟,为NH3与HCl反应生成NH4Cl,A、B分别为HCl、NH3中的一种,结合转化关系可知Y为H2,氯化铵的电子式为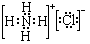 ,
,
故答案为:H2;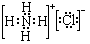 ;
;
(7)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,B具有漂白性,结合转化关系可推知,Y为S、X为H2、A为H2S、Z为O2、B为SO2.将B与氯气的水溶液充分反应可生成两种强酸,是二氧化硫和氯气在水中发生反应生成硫酸和氯化氢,反应的化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl;
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl.
点评 本题元素化合物的推断,属于拼合型题目,需要学生熟练掌握元素化合物知识,较好的考查学生对知识的迁移运用能力,(4)中关键是明确NaH与水的反应,再利用方程式计算解答.


科目:高中化学 来源: 题型:选择题
 将1molH2(g)和2mol I2(g)置于某2L密闭容器中,在一 定温度下发生反应:H2(g)+I2(g)?2HI(g)△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如曲线如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( )
将1molH2(g)和2mol I2(g)置于某2L密闭容器中,在一 定温度下发生反应:H2(g)+I2(g)?2HI(g)△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如曲线如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( )| A. | 恒温恒容加入适当催化剂 | B. | 恒温条件缩小体积 | ||
| C. | 恒容条件下升高温度 | D. | 恒温条件扩大反应容器 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖可用于补钙药物的合成 | |
| B. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| C. | 聚乙烯塑料制品可用于食品的包装 | |
| D. | 生石灰可用作食品抗氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
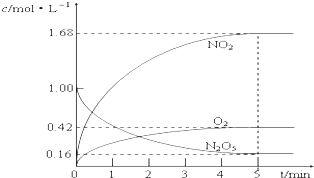 (1)该反应的化学方程式为2N2O5?4NO2+O2
(1)该反应的化学方程式为2N2O5?4NO2+O2查看答案和解析>>
科目:高中化学 来源: 题型:解答题
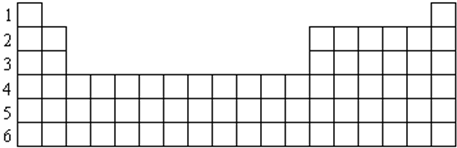
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | |||||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑧ | ⑩ | ||
| 4 | ② | ④ | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
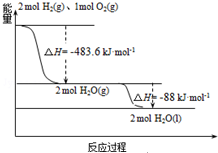 发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:| A. | H2(g)与O2(g)反应生成H2O(g)放热483.6kJ•mol-1 | |
| B. | 氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| C. | 火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)═2H2O(g)△H=-474.92kJ•mol-1 | |
| D. | H2O(g)=H2O(l)△H=-88kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com