
【题目】中国科学家研究出对环境污染小、便于铝回收的海水电池,其工作原理示意图如下:
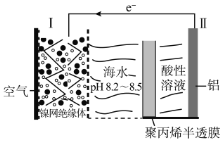
下列说法正确的是( )
A.电极Ⅰ为阴极,其反应为:O2+4H++4e-=2H2O
B.聚丙烯半透膜允许阳离子从右往左通过
C.如果电极II为活性镁铝合金,则负极区会逸出大量气体
D.当负极质量减少5.4g时,正极消耗3.36L气体
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】镍是有机合成的重要催化剂.某化工厂有含镍催化剂废品![]() 主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质
主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质![]() 某学习小组设计如图流程利用含镍催化剂废品制备硫酸镍晶体:
某学习小组设计如图流程利用含镍催化剂废品制备硫酸镍晶体:

几种难溶碱开始沉淀和完全沉淀的pH如表:
沉淀物 | 开始沉淀 | 完全沉淀 |
|
|
|
|
|
|
|
|
|
|
|
|
回答下列问题:
(1)溶液①中含金属元素的离子是 ______ .
(2)用离子方程式表示加入双氧水的目的 ______ ![]() 双氧水可以用下列物质替代的是 ______ .
双氧水可以用下列物质替代的是 ______ .
A.氧气B.漂液C.氯气D.硝酸
(3)取![]() 硫酸镍晶体样品溶于蒸馏水,用
硫酸镍晶体样品溶于蒸馏水,用![]() 的
的![]() 标准溶液滴定至终点,消耗EDTA标准溶液为
标准溶液滴定至终点,消耗EDTA标准溶液为![]() 滴定反应为
滴定反应为![]() 计算样品纯度为 ______
计算样品纯度为 ______ ![]() 已知,
已知,![]() 相对分子质量为281,不考虑杂质反应
相对分子质量为281,不考虑杂质反应![]() .
.
(4)操作b调节溶液范围为![]() ,其目的是 ______
,其目的是 ______ ![]() 固体②的化学式为 ______ .
固体②的化学式为 ______ .
(5)操作a和c需要使用的仪器除铁架台![]() 带铁圈
带铁圈![]() 、烧杯、酒精灯、玻璃棒外还需要的主要玻璃仪器是 ______
、烧杯、酒精灯、玻璃棒外还需要的主要玻璃仪器是 ______ ![]() 上述流程中,“酸浸”时所加入的酸是 ______
上述流程中,“酸浸”时所加入的酸是 ______ ![]() 填化学式
填化学式![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(化学反应原理)
恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
(1)从开始反应到平衡状态,生成C的平均反应速率为___。
(2)该反应的化学平衡表达式为___。
(3)下列各项可作为该反应达到平衡状态的标志是___。
A.压强不再变化 B.气体密度不再变化
C.气体平均相对分子质量不再变化 D.A的消耗速率与B的消耗速率之比为2:1
II.(化学与生活)
有四种常见药物①阿司匹林②青霉素③胃舒平④麻黄碱。请回答:
(1)某同学胃酸过多,应选用的药物是___(填序号)。
(2)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是___(填序号)。
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是___(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在K2Cr2O7溶液中存在下列平衡:![]() (黄色)+2H+
(黄色)+2H+![]() (
(![]() 橙色)+H2O中,溶液颜色介于黄色和橙色之间,今欲使
橙色)+H2O中,溶液颜色介于黄色和橙色之间,今欲使![]() 的物质的量增大,可以在溶液中加入①H+ ②OH- ③K+ ④
的物质的量增大,可以在溶液中加入①H+ ②OH- ③K+ ④![]() ( )
( )
A.①③B.②④C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据转化关系判断下列说法不正确的是( )
![]()
A.反应①中,(C6H10O5)n可表示淀粉或纤维素
B.反应②中,1mol葡萄糖可生成2mol乙醇
C.乙醇、乙酸和乙酸乙酯互为同系物
D.将铜丝在空气中灼烧后趁热插入乙醇中可得到乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告中提出要“打赢蓝天保卫战”,意味着对污染防治比过去要求更高。某种利用垃圾渗透液实现发电、环保二位一体结合的装置示意图如下,当该装置工作时,下列说法正确的是

A.盐桥中Cl-向Y极移动
B.电路中流过7.5 mol电子时,共产生标准状况下N2的体积为16.8L
C.电流由X极沿导线流向Y极
D.Y极发生的反应为2NO3-+10e-+6H2O===N2↑+12OH—,周围pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400~600 ℃下的催化氧化:2SO2+O2![]() 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
A. 使用催化剂是为了加快反应速率,提高生产效率
B. 在上述条件下,SO2不可能100%地转化为SO3
C. 为了提高SO2的转化率,应适当提高O2的浓度
D. 达到平衡时,SO2的浓度与SO3的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 由于乳酸(![]() )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
C. HF的稳定性很强,是因为其分子间能形成氢键
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com