
【题目】25![]() C时,水的电离平衡:H2O
C时,水的电离平衡:H2O![]() H++OH-
H++OH-![]() H>0,下列叙述正确的是
H>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体NaOH,平衡逆向移动,c(OH-)降低
D.将水加热,Kw增大,c(H+)不变
科目:高中化学 来源: 题型:
【题目】依据甲、乙、丙三个图回答下列问题:

(1)①甲装置中,锌为_____极,锌电极上电极反应式为________________
②乙装置中,锌为_____极,锌电极上电极反应式为________________
(2)丙装置中,Cu2+浓度________(填“增大”“减小”或“不变”),原因是_______________________________________________________________________
(3)在25 ℃时,用石墨电极电解2.0 L 0.5 mol·L-1CuSO4溶液。5 min后,在一个石墨电极上有6.4 g Cu生成。试回答下列问题:
若电解后溶液的体积不变,则电解后溶液的[H+]为___________。
若将溶液恢复到与电解前一样,则需加入_____mol的______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.56克Cu完全溶于一定量的浓HNO3中,生成的气体恰好充满500mL的烧瓶,然后将该烧瓶倒置于水中,缓缓通入一定量的氧气后容器内刚好充满水,则通入的氧气为( )
A.0.16gB.0.02molC.0.224gD.0.32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚对苯二甲酸乙二醇酯(PET)俗称涤纶,是一种重要的有机高分子材料。其结构为![]() 。其合成路线如图:
。其合成路线如图:
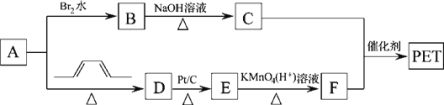
已知:![]()

回答下列问题:
(1)B的名称是__,C中官能团的电子式为__。
(2)A→D的反应类型为___。
(3)E的结构简式为___。
(4)写出C+F→PET的化学反应方程式__。
(5)G是F的同系物,其相对分子质量比F多14,则符合该条件的G的结构共有__种,写出其中苯环上只有一个取代基的结构简式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写下列化学方程式:
(1)丙烯的加聚___;
(2)甲苯制TNT___;
(3)乙醇与浓硫酸共热消去反应___;
(4)乙二醇和乙二酸脱水成六元环的酯___;
(5)乙醛和银氨溶液反应___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国女药学家屠呦呦因成功提取青蒿素而获得2015年诺贝尔医学奖,有关青蒿素的结构如图所示,下列关于靑蒿素的推断,不合理的是( )
A. 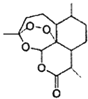 青蒿素的分子式是
青蒿素的分子式是![]()
B. 青蒿素所有碳原子均在同一平面上
C. 青蒿素在碱性条件下不能稳定存在
D. 青蒿素可以发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的说法正确的是
A.某温度下 c(H+)=![]() 的溶液一定是中性溶液
的溶液一定是中性溶液
B.室温下,向 0.1 mol·L-1 的 CH COOH 溶液中加入少量显碱性的 CH COONa,CH COOH 的电离程度一定增大
C.浓度均为 0.1 mol·L-1 的①(NH4 ) 2CO3 、②NH4HSO4 、③(NH4)2Fe(SO4)2、④NH4 Cl 溶液中,c(NH4+)的大小顺序为①>③>②>④
D.强酸强碱盐的水溶液一定呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有___、___。
(2)取10.00mL待测液,用___滴定管量取。
(3)用0.2010mol/L标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视___,直到滴定到终点。
(4)根据下列数据,c(NaOH)=___,烧碱的纯度为___。
滴定次数 | 待测液体积 (mL) | 标准盐酸的体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)以标准盐酸溶液滴定未知的氢氧化钠溶液为例,判断下列操作引起的误差(填偏大、偏小、无影响)
①读数:滴定前平视,滴定后俯视___。
②未用标准液润洗滴定管___。
③用待测液润洗锥形瓶___。
④不小心将标准液滴在锥形瓶外面___。
⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组设计以下实验方案,测定某含有NaCl的小苏打样品中![]() 的质量分数。
的质量分数。
(方案一)查资料:NaCl加热至![]() 时熔化而不分解,
时熔化而不分解,![]() 受热分解,
受热分解,![]() 。由此设计实验:用电子天平称取
。由此设计实验:用电子天平称取![]() 样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于
样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于![]() ,不超过
,不超过![]() ),至恒重后,冷却,称量剩余固体质量为
),至恒重后,冷却,称量剩余固体质量为![]() 。
。
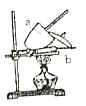
(1)实验中至少称量____次。
(2)实验中,达到恒重操作的标准是__________。
(方案二)根据“![]() 溶液呈碱性,
溶液呈碱性,![]() ”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
1 | 2 | |
| 20.00 | 20.00 |
| 0.00 | 0.20 |
| 19.98 | 20.22 |
(3)实验中,当其它操作均正确时,下列操作不会引起实验误差的是(______)。
A.容量瓶用蒸馏水洗净后,瓶内有水残留,直接配制溶液
B.滴定管内壁有水珠就装入标准液
C.锥形瓶内壁有水珠,用待测液润洗后再使用
D.锥形瓶用蒸馏水洗净后,直接放入待测液进行测定
span>(4)滴定终点的判断:__________。
(5)两次实验消耗盐酸体积的平均值为__________mL。
(6)样品中![]() 的质量分数__________。
的质量分数__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com