
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知: ① Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O ② SO2+SeO2+ H2O ![]() Se + SO42-+ H+
Se + SO42-+ H+
(1)依据Se与浓H2SO4的反应,写出Se和浓HNO3(还原产物为NO2)反应的化学方程式:__________________。
(2)Se与浓HNO3的反应中,氧化剂是_______, 反应中被还原的元素是_______。当有标准状况下33.6LNO2气体生成时,转移电子的物质的量是________mol。
(3)依据反应①②, 判断SeO2、浓H2SO4、SO2的氧化性由强到弱的顺序是__________。
(4) 配平反应②, 并用双线桥法标出电子转移的方向和数目:_____________________。
【答案】Se+4HNO3(浓)===== SeO2+4NO2↑+2H2O 浓HNO3 N 1.5 浓H2SO4 > SeO2 > SO2 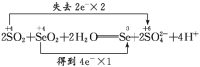
【解析】
利用题中信息可知Se与浓HNO3反应,Se被氧化为+4价的SeO2,浓HNO3还原为NO2;反应中浓HNO3做氧化剂,N元素被还原;在氧化还原反应中,氧化剂的氧化性强于氧化产物,还原剂的还原性强于还原产物;SO2与SeO2反应中,SO2做还原剂,被氧化为H2SO4,SeO2做氧化剂,被还原为单质Se,进而确定各物质的量的系数配平方程式,确定转移电子数目,标出电子转移的方向和数目。
(1)利用题中信息可知Se与浓HNO3反应,Se被氧化为+4价的SeO2,反应中S元素化合价升高4,浓HNO3还原为NO2,反应中化合价降低1,化合价升降最小公倍数为4,由化合价升降法配平得反应的化学方程式:Se+4HNO3(浓)=SeO2+4NO2↑+2H2O。(2)反应中浓HNO3做氧化剂,N元素被还原;标准状况下33.6LNO2气体的物质的量为1.5mol,反应转移的电子数目为1.5mol×1=1.5mol。(3)在氧化还原反应中,氧化剂的氧化性强于氧化产物,所以根据反应的方程式可知,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>SO2。(4)SO2与SeO2反应中,SO2做还原剂,被氧化为H2SO4,化合价升高2,SeO2做氧化剂,被还原为单质Se,Se元素化合价降低4,化合价升降最小公倍数为4,由化合价升降法配平得反应的化学方程式:2SO2+SeO2+ 2H2O=Se +2SO42-+4 H+,用双线桥法标出电子转移的方向和数目如下: 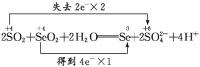 。
。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】下列问题,与盐类水解有关的是
①NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂
②NaHCO3与Al2(SO4)3两种溶液用于制造泡沫灭火器
③将含有CaSO4的水垢用Na2 CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A. ①②⑤ B. ②③④ C. ①②④⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法正确的是( )
A.饮用牛奶和豆浆可以缓解重金属引起的中毒
B.二氧化硅用于制造太阳能电池
C.氨气泄漏时,用湿毛巾捂住口鼻,并尽量向高处去
D.用医疗垃圾中的废塑料生产一次性水杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、CO32-、SO42-中的不同阳、阴离子各一种组成已知:
①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;
②0.1mol/L乙溶液中c(H+)>0.1mol/L;
③向丙容器中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。
(1)甲是_____________,乙是_____________,丙是_____________,丁是_____________。
(2)50mL含Na2SO4、Na2CO3的混合溶液中加入过量的甲溶液,得到14.51g白色沉淀,向白色沉淀中加入过量的稀HNO3充分反应后,沉淀减少到4.66g,并有气体产生。
①写出产生气体的离子方程式:______________________________;
②混合溶液中Na+的物质的量的浓度是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )

A. HA为强酸 B. 该混合液pH=7
C. 图中X表示HA,Y表示OH-,Z表示H+ D. 该混合溶液中:c(A—)+ c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AgCl的沉淀溶解平衡为AgCl(s)![]() Ag+(aq)+Cl(aq),下列说法中错误的是()
Ag+(aq)+Cl(aq),下列说法中错误的是()
A. 加入水后溶解平衡不移动
B. AgCl饱和溶液中c(Ag+)=![]() mol/L
mol/L
C. 用NaCl溶液代替蒸馏水洗涤AgCl沉淀,可以减少沉淀损失
D. 反应AgCl+NaBr=AgBr+NaCl易进行,说明溶解度:AgCl>AgBr
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com