
【题目】CPAE是蜂胶的主要活性成分,它可由咖啡酸合成,其合成过程如下。下列说法不正确的是

A. CPAE存在顺反异构体
B. 可用金属Na检测上述反应结束后是否残留苯乙醇
C. 与苯乙醇互为同分异构体的酚类物质共有9种
D. 咖啡酸可发生聚合反应,并且其分子中含有3种官能团
【答案】B
【解析】
咖啡酸含碳碳双键,酚羟基和酯基3种官能团,苯乙醇的官能团为羟基,CPAE的官能团为碳碳双键,酚羟基和酯基。
A项、CPAE分子中两个不饱和碳原子连有的原子和原子团不相同,存在顺式结构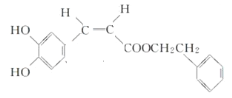 和反式结构
和反式结构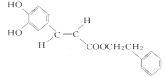 ,故A正确;
,故A正确;
B项、CPAE中含酚羟基、苯乙醇中含羟基,均与Na反应生成氢气,则不能用金属Na检测上述反应是否残留苯乙醇,故B错误;
C项、与苯乙醇互为同分异构体的酚类物质,含酚-OH、乙基(或2个甲基),含酚-OH、乙基存在邻、间、对三种;两个甲基处于邻位的酚2种,两个甲基处于间位的有3种,两个甲基处于对位的有1种,共9种,故C正确;
D项、咖啡酸含碳碳双键,酚羟基和酯基等3种官能团,含有碳碳双键的有机物能够发生加聚反应,故D正确。
故选B。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】镍与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____,基态As原子核外有_________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____和+3。砷的电负性比镍____(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是___________________________________________。
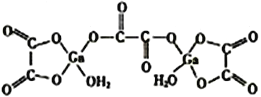
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为______,草酸根中碳原子的杂化方式为______________。
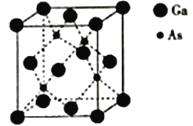
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_________,晶体的密度为___________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图实验室某浓盐酸试剂瓶标签上的有关数据,下列说法正确的是

A. 该浓盐酸中HCl的物质的量浓度为11.9mol·L-1
B. 溶液中HCl的物质的量不随所取体积的多少而变化
C. 配制500 mL0.400 mol·L-1的稀盐酸需要量取浓盐酸1.68mL
D. 中和含0.4 g NaOH的NaOH溶液需取0.400 mol·L-1的稀盐酸2.5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“毒鼠强”是一种灭鼠药,具有极强的毒性,国家已禁止使用。它是一种含有C、H、O、N、S的有机物,其摩尔质量为240![]() ;其中所含碳元素的质量分数为20%,所含氢元素的质量分数为3.0%,所含氧元素的质量分数为28%,其余为N、S。
;其中所含碳元素的质量分数为20%,所含氢元素的质量分数为3.0%,所含氧元素的质量分数为28%,其余为N、S。
(1)误食0.1g “毒鼠强”就可以使人死亡,0.1g “毒鼠强”的物质的量为_______?
(2)试求“毒鼠强”中C、H、O三种元素的原子个数比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我校环保兴趣小组在处理污水样品时,需用2mol/L的盐酸配制成250mL0.1mol/L的盐酸溶液。
(1)计算所需2mol/L的盐酸的体积是_____________。
(2)在容量瓶的使用方法中,下列操作正确的是_______________。
A、使用容量瓶前检查它是否漏水
B、容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C、配制溶液时,将量筒量取好的盐酸直接倒入容量中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D、盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(3)配制时其他操作均正确,若定容时俯视刻度线,所配溶液的物质的量浓度_________。(填“偏高”;“偏低”“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象与对应实验操作相符合的是( )
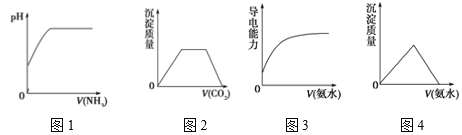
A. 图1 表示在水中慢慢通入氨气至过量
B. 图2表示在氢氧化钠和偏铝酸钠混合溶液中通入二氧化碳至过量
C. 图3表示在醋酸溶液中慢慢滴加同浓度的氨水至过量
D. 图4表示在氯化铝溶液中滴加氨水至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.2mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
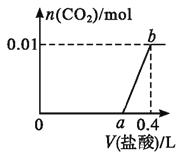
A.在0~a范围内,只发生反应OH-+H+=H2O
B.a=0.35
C.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
D.原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-环乙二醇可通过下列路线合成(某些反应的反应物和反应条件未列出):
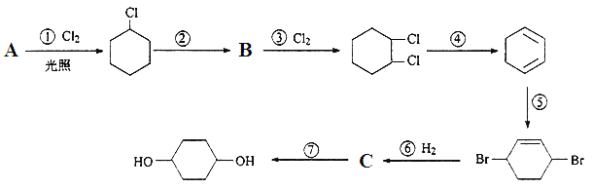
1,4-环乙二醇
(1)A的结构简式是___________________________。
(2)反应②应所需的试剂和条件是_______________________________。
(3)写出反应④、⑦的化学方程式:
④____________________________________________;
⑦_________________________________________。
(4)①的反应类型是_________,②的反应类型是_________,上述七个反应中属于加成反应的有_________(填反应序号),
(5)反应⑤中可能产生一定量的有机副产物,其可能的结构简式为________________________。(写出一种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属和非金属在人类生产生活中得到了广泛应用,请你回答下列问题。
(1)面包发酵粉的主要成分之一是一种钠盐,其俗称为________;漂白粉的有效成分为__________(写化学式);FeCl3常用作净水剂,其原理为_________(用离子方程式表示)。
(2)沾有水的铁制器皿在高温火焰上会发黑,该反应的化学方程式是_________。
(3)人体血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化Fe3+而中毒,服用维生素C可以解毒.对上述的分析正确的是(______)
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C被氧化 D.亚硝酸盐发生氧化反应
(4)某CuSO4、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相等(不考虑水解),且SO42-的物质的量浓度为6mol/L,则此溶液中阳离子的浓度为___________mol/L,若向此溶液中加入金属Zn,则最多溶解Zn的质量为____________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com