
【题目】下列关于古籍中的记载说法不正确的是( )
A. 《吕氏春秋·别类编》中“金(即铜)柔锡柔,合两柔则刚”,体现了合金硬度方面的特征
B. 《天工开物》中有“至于矾现五金色之形,硫为群石之将,皆变化于烈火”,其中的矾指的是金属硫化物
C. 《本草纲目》中记载:“此即地霜也。所在山泽,冬月地上有霜,扫取以水淋汁,后乃煎炼而成。”文中对硝酸钾的提取涉及溶解、蒸发、结晶操作
D. 《清嘉录》中记载:“研雄黄末,屑蒲根,和酒饮之,谓之雄黄酒。”其中的雄黄是![]()
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
实验方案①:铝镁合金![]() 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积
实验方案②:铝镁合金![]() 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积
实验方案③:铝镁合金![]() 溶液
溶液![]() 过滤、洗涤、干燥后测定得到沉淀的质量
过滤、洗涤、干燥后测定得到沉淀的质量
对能否测定出镁的质量分数的实验方案判断正确的是( )
A. 都能B. 都不能C. ①不能,其它都能D. ②③不能,①能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下三个氧化还原反应的化学方程式:
①2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
②2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
③2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
(1)反应①中氧化剂为________,还原剂为________。
(2)反应②中该反应中Fe2O3发生了________反应,Al发生了________反应。
(3)反应③中每生成1molO2,转移电子的物质的量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.2mol/L的Na2SO4溶液和50mL0.2mol/L的Al2(SO4)3溶液混合后,溶液中SO42-离子的物质的量浓度为(设混合前后溶液的体积不变)( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C向![]() 中滴加
中滴加![]() 过程中,
过程中,![]() 变化如图所示。
变化如图所示。

(1)A点溶液![]() ,用化学用语解释原因:_________________。
,用化学用语解释原因:_________________。
(2)下列有关B点溶液的说法正确的是_______________(填字母序号)。
a. 溶质为:![]()
b. 微粒浓度满足:![]()
c. 微粒浓度满足:![]()
(3)![]() 两点水的电离程度:
两点水的电离程度:![]() ______
______![]() (填“
(填“![]() ”、“
”、“ ![]() ”或“
”或“![]() ”)。
”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下十种物质:①稀H2SO4②纯醋酸(CH3COOH)③NaOH溶液④FeCl3固体⑤CaCO3固体⑥CO2⑦熔融NaHSO4⑧Ba(HCO3)2溶液⑨乙醇(C2H5OH)⑩NH3H2O请回答下列问题
(1)其中能导电的是______;其中属于非电解质的是______;属于弱电解质的是______。(填序号)
(2)将题中④物质溶于水配成饱和溶液,滴入沸水中,继续煮沸至出现红褐色可制得Fe(OH)3胶体,写出该过程的化学方程式______。
(3)按要求写出题中各物质发生反应的离子方程式
①与⑧反应______;
②的水溶液与⑤的反应______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,不正确的是( )
A. 侯氏制碱法:![]()
B. 向![]() 溶液中滴加
溶液中滴加![]() 溶液:
溶液:![]()
C. 氧化铁与足量的![]() 溶液反应:
溶液反应:![]()
D. 已知酸性的强弱:![]() ,则向
,则向![]() 溶液中通入少量的
溶液中通入少量的![]() 时:
时:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了前20号元素中的某些元素性质的有关数据:
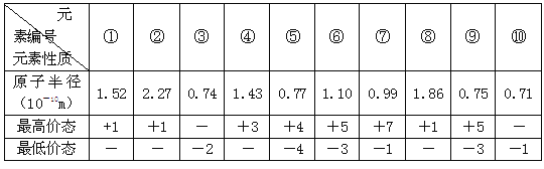
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是____________(填写编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是______(写分子式)。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于______;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式______。
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为______。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某软锰矿的主要成分为![]() ,还含有
,还含有![]() 等杂质,用该软锰矿制备
等杂质,用该软锰矿制备![]() 的流程图如图:
的流程图如图:
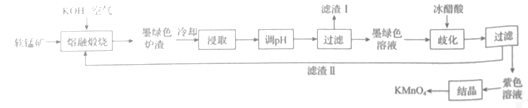
已知:I.![]() 固体和溶液均为黑绿色;
固体和溶液均为黑绿色;
II.![]() 溶液中存在以下平衡:
溶液中存在以下平衡:![]()
回答下列问题:
(1)“熔融煅烧”时,![]() 参与反应的化学方程式为_____。
参与反应的化学方程式为_____。
(2)“浸取“过程中,为加快浸取速率。可以采取的措施有____(写出两点)。向浸取液中通入![]() 调节其pH,经“过滤”得滤渣I,滤渣I的成分是____(填化学式)。
调节其pH,经“过滤”得滤渣I,滤渣I的成分是____(填化学式)。
(3)“歧化”时,加入冰醋酸的目的是____。“歧化”时,下列酸可以用来代替冰醋酸的有____(填字母)。
a.乙二酸 b.亚硫酸 c.氢溴酸 d.稀硫酸
(4)“结晶”时,当___时,停止加热,自然冷却,抽滤后即可获得紫黑色![]() 晶体。
晶体。
(5)已知![]() 能与热的硫酸酸化的
能与热的硫酸酸化的![]() 反应生成
反应生成![]() 和
和![]() 。取上述制得的
。取上述制得的![]() 产品7.0g,恰好与13.4g
产品7.0g,恰好与13.4g![]() 完全反应,则
完全反应,则![]() 的纯度为____%(结果保留1位小数)。
的纯度为____%(结果保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com