
【题目】汽车尾气的主要成分有CO、SO2、氮氧化物等,科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
(1)已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-113.0KJ/mol
2SO2(g)+O2(g)=2SO3(1) ΔH2=-288.4KJ/mol
N2(g) + O2(g) = 2NO(g) △ H3=+180.5 kJ·mol-1
请判断反应NO2(g)+SO2(g)=NO(g)+SO3(1) ΔH4,在低温下能否自发进行,并说明理由______________________。
(2)已知TiO2催化尾气降解原理为:2CO(g)+O2(g) ![]() 2CO2(g); 2H2O(g)+4NO(g)+O2(g)
2CO2(g); 2H2O(g)+4NO(g)+O2(g) ![]() 4HNO3(g)。
4HNO3(g)。
Ⅰ.在O2浓度几乎不变的条件下,模拟CO、NO的降解,得到降解率随时间变化如图1所示(![]() ),反应40秒后检测HNO3气体浓度有所降低,请用化学方程式结合化学反应原理知识解释出现该现象可能的原因_______________________。
),反应40秒后检测HNO3气体浓度有所降低,请用化学方程式结合化学反应原理知识解释出现该现象可能的原因_______________________。

Ⅱ.图2为在不同颗粒间隙的沥青混凝土(α、β型)和不同温度下,实验进行相同一段时间(t秒)后测得的CO降解率变化,回答谢列问题:

①已知50℃、t秒时容器中O2浓度为0.01mol/L,求此温度下CO降解反应的平衡常数_______。
②下列关于图2的叙述不正确的是_________
A.根据降解率由b点到c点随温度的升高而增大,可知CO降解反应的平衡常数Kb<Kc
B.相同温度下β型沥青混凝土中CO降解速率比α型要大
C.a点的数据反映出CO与O2之间所发生的有效碰撞频率是整个实验过程中最高的
D.d点降解率出现突变的原因可能是温度升高后催化剂失效
③科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10-60℃范围内进行实验,请在图2中用线段与阴影仿照“示例”描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(示例:![]() )。________________________
)。________________________
(3)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式_______。
【答案】 经计算ΔH4=(113.0-288.4)×0.5=-87.7KJ/mol<0,且可判断反应的ΔS<0,故在低温下可自发进行 40秒后发生反应2NO=N2+O2生成氮气,并且NO浓度降低,平衡2H2O+4NO+O2![]() 4HNO3逆向移动,造成HNO3浓度降低
4HNO3逆向移动,造成HNO3浓度降低 ![]() AC
AC 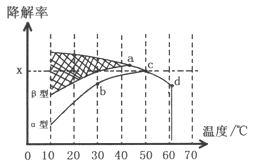 Ti-4e-+2H2O=TiO2+4H+
Ti-4e-+2H2O=TiO2+4H+
【解析】试题分析:(1)根据△H-T△S判断;Ⅰ. 40秒后发生反应2NO=N2+O2生成氮气,并且NO浓度降低;据此分析平衡移动;Ⅱ. ①根据平衡常数表达式计算;②根据影响反应速率和反应限度的因素分析;(3)阳极失电子发生氧化反应;
解析:(1)①2NO(g)+O2(g)=2NO2(g) ΔH1=-113.0kJ/mol
②2SO2(g)+O2(g)=2SO3(1) ΔH2=-288.4kJ/mol
根据盖斯定律②×![]() -①×
-①×![]() 得 NO2(g)+SO2(g)=NO(g)+SO3(1) ΔH3=(113.0-288.4)×0.5=-87.7kJ/mol;气体物质的量减少,ΔS<0,ΔH<0,根据△H-T△S<0能自发进行,所以在低温下可自发进行;(2)Ⅰ.40秒后发生反应2NO=N2+O2生成氮气,并且NO浓度降低,NO浓度降低使平衡2H2O+4NO+O2
得 NO2(g)+SO2(g)=NO(g)+SO3(1) ΔH3=(113.0-288.4)×0.5=-87.7kJ/mol;气体物质的量减少,ΔS<0,ΔH<0,根据△H-T△S<0能自发进行,所以在低温下可自发进行;(2)Ⅰ.40秒后发生反应2NO=N2+O2生成氮气,并且NO浓度降低,NO浓度降低使平衡2H2O+4NO+O2![]() 4HNO3逆向移动,造成HNO3浓度降低;Ⅱ. ①设初始CO的浓度为a mol/L,
4HNO3逆向移动,造成HNO3浓度降低;Ⅱ. ①设初始CO的浓度为a mol/L,
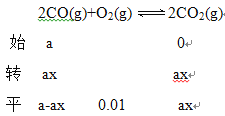
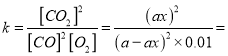
![]() ;
;
②A.根据降解率由b点到c点随温度的升高而增大,b点不是平衡状态,故A错误;
B. 根据图示,相同温度下β型沥青混凝土反应速率快,故B正确;
C.温度越高,有效碰撞频率越高,故C错误;
D.在适宜的温度下催化剂的效果最好,故D正确;
③催化剂加快反应速率,所以10℃、t秒时就达到平衡,根据升高温度平衡转化率降低,可得图像如下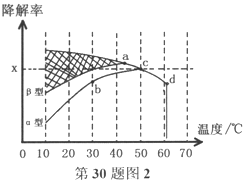
(3)以金属钛为阳极进行电解,阳极失电子发生氧化反应,生成TiO2,阳极的电极反应式为Ti-4e-+2H2O=TiO2+4H+。


科目:高中化学 来源: 题型:
【题目】反应NH4HS(s) ![]() NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况下,不会使平衡发生移动的是
NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况下,不会使平衡发生移动的是
A. 温度、容积不变时,通入SO2气体 B. 将NH4HS固体全部移走
C. 容器体积不变,充入氮气 D. 保持压强不变,充入氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产和生活密切相关。下列过程中没有发生化学变化的是
A. 氦气可用于填充飞艇 B. 氯气用于自来水杀菌消毒
C. 二氧化硫作纸浆的漂白剂 D. 肥皂水作蚊虫叮咬处的淸洗剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.升高温度可降低活化能
B.废电池需回收,主要是要利用电池外壳的金属材料
C.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
D.推广使用太阳能、风能、地热能、氢能,有利于缓解温室效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铜电极的叙述正确的是
A.铜锌原电池中铜是负极B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时可用铜作阳极D.电解食盐水时铜作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1mol任何气体的体积都为22.4 L
B. 1 mol任何物质在标准状况下所占的体积都为22.4 L
C. 标准状况下,1 mol水所占的体积是22.4 L
D. 标准状况下,22.4 L的任何气体的物质的量都是1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1为实验室制备、收集少量HCl的装置.
①制备HCl所用药品为浓硫酸和浓盐酸,则甲的最佳装置应选用图2中的 . 
②请解释能用浓硫酸和浓盐酸制备HCl气体的原因 .
③装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是 ( )
① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
② 1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH4+ 物质的量完全相等
③ pH相等的四种溶液:a.CH3COONa b.NaClO c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
④ pH=8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3)
⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+)
⑥ pH=4浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
A. ③⑤⑥ B. ①③⑤ C. ①②④ D. ②④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com