
【题目】室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如下图所示。下列说法正确的是
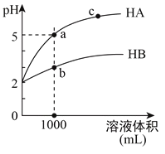
A.HA的酸性比HB的酸性弱
B.a点溶液的导电性比c点溶液的导电性强
C.若两溶液无限稀释,则它们的n(H+)相等
D.对a、b两点溶液同时升高温度,则![]() 增大
增大
【答案】B
【解析】
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释至1000mL时,HA溶液PH=5,HB溶液PH<5,说明HA为强酸,HB为弱酸,据此分析解答。
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释至1000mL时,HA溶液PH=5,HB溶液PH<5,说明HA为强酸,HB为弱酸,
A. 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释至1000mL时,HA溶液PH=5,HB溶液PH<5,说明HA为强酸,HB为弱酸,A项错误;
B. a点溶液中离子浓度大于c点溶液中离子浓度,溶液导电性取决于离子浓度的大小,则a点溶液的导电性比c点溶液的导电性强,B项正确;
C. 溶液无限稀释接近为水的电离,氢离子浓度接近为10-7mol/L,若两溶液无限稀释,则它们的c(H+)相等,但是若体积不相等,则n(H+)不相等,C项错误;
D. HA为强酸,HB为弱酸,对a、b两点溶液同时升高温度,c(A-)浓度不变,HB电离程度增大,c(B-)浓度增大,则![]() 减小,D项错误;
减小,D项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】下列事实不属于盐类水解应用的是( )
A.纯碱溶液去油污
B.草木灰与铵态氮肥不能混合施用
C.浓的硫化钠溶液有臭味
D.实验室用Zn和稀H2SO4制氢气时加入少量CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列各题的填空:
(1)氢化钠(NaH)电子式为______,氢负离子的离子结构示意图为______;
(2)元素X的最外层电子数是次外层电子数的2倍,该元素名称是___,该元素核外电子排布式为______,画出该元素的外围电子排布图______;
(3)前四周期元素中,未成对电子数为5的元素符号是___ ,该元素在周期表中的位置为第__周期___族, ___区;
(4)C、N、O的第一电离能由大到小的顺序为______,由这三种元素和氢原子共同组成的离子化合物的化学式为______,
(5)亚硒酸根离子(SeO32-)的VSEPR模型为______,其中心原子的轨道杂化方式为______;
(6)向硫酸铜溶液中逐滴加入氨水至得到蓝色透明溶液后,再加入极性较小的溶剂乙醇,析出深蓝色晶体![]() ,该晶体中配离子为____ ,配离子中的配位体为___ ,配位数为___。
,该晶体中配离子为____ ,配离子中的配位体为___ ,配位数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是![]() ,含
,含![]() 、
、![]() 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:
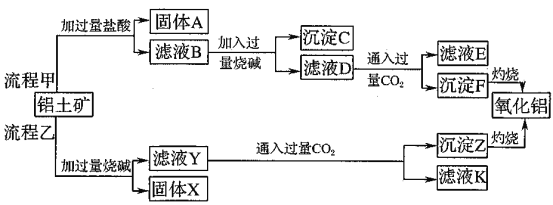
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为_________.
(2)流程乙加入烧碱后生成SiO32-的离子方程式为________.
(3)验证滤液B含![]() ,可取少量滤液并加入________(填试剂名称)。
,可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中溶质的主要成份是________(填化学式),写出该溶液的一种用途________
(5)已知298K时,![]() 的容度积常数
的容度积常数![]() =5.6×
=5.6×![]() ,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的
,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的![]() =_______.
=_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国神舟十一号载人飞船在酒泉卫星发射中心成功发射,为我们更好地掌握空间交会对接技术、开展地球观测活动奠定了基础。我国制造航天飞船的主要材料是铝,因而其也被称为会飞的金属,请根据其性质回答下列问题:
(1)现在工业冶炼铝的化学方程式为 _______________。
(2)铝锂形成化合物LiAlH4既是金属储氢材料又是有机合成中的常用试剂,遇水能得到无色溶液并剧烈分解释放出H2,LiAlH4在化学反应中通常作_______(填“氧化”或“还原”)剂。
(3)铝电池性能优越,在现代生产、生活中有广泛的应用。
①Al-Ag2O电池可用作水下动力电源,化学反应为:2Al+3Ag2O+2NaOH+3H2O=2Na[Al(OH)4]+6Ag,则负极的电极反应式为_______________,正极附近溶液的pH________(填“变大”“不变”或“变小”)。
②铝一空气电池以其环保、安全而受到越来越多的关注,其原理如下图所示。
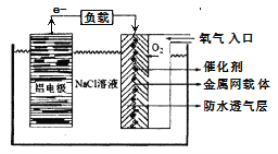
该电池的正极反应方程式为_______________;电池中NaCl溶液的作用是_______________;以该电池为电源,用惰性电极电解Na2SO4溶液,当Al电极质量减少1.8g时,电解池阴极生成的气体在标准状况下的体积为____________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组研究了其他条件不变时,改变条件对可逆反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0的影响。下列说法正确的是
2SO3(g) ΔH<0的影响。下列说法正确的是

A. 图1研究的是温度、压强对平衡的影响,横轴表示压强
B. 图2研究的是温度对平衡的影响,Ⅱ采用的温度更低
C. 图3中t0时使用了催化剂,使平衡向正反应方向移动
D. 图4中t0时增大压强,使平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应方向及其判据的说法中错误的是( )
A.1molH2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)]
B.自发进行的反应一定能迅速进行
C.CaCO3(s)![]() CaO(s)+CO2(g)△H>0能否自发进行与温度有关
CaO(s)+CO2(g)△H>0能否自发进行与温度有关
D.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中充入CO和![]() 各
各![]() mol,一定温度下发生反应:
mol,一定温度下发生反应:![]() ,下列叙述正确的是
,下列叙述正确的是
A.如果容器内压强不再改变,则证明该反应已达到平衡状态
B.寻找合适的催化剂是加快反应速率并提高![]() 产率的有效措施
产率的有效措施
C.当反应达到平衡后,保持容器内体积不变,再向其中充入CO和![]() 各1mol,达到新的平衡后
各1mol,达到新的平衡后![]() 的产率会增大
的产率会增大
D.如果在某温度下平衡常数为![]() ,则平衡时CO转化率为
,则平衡时CO转化率为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com