
【题目】请完成下列各题的填空:
(1)氢化钠(NaH)电子式为______,氢负离子的离子结构示意图为______;
(2)元素X的最外层电子数是次外层电子数的2倍,该元素名称是___,该元素核外电子排布式为______,画出该元素的外围电子排布图______;
(3)前四周期元素中,未成对电子数为5的元素符号是___ ,该元素在周期表中的位置为第__周期___族, ___区;
(4)C、N、O的第一电离能由大到小的顺序为______,由这三种元素和氢原子共同组成的离子化合物的化学式为______,
(5)亚硒酸根离子(SeO32-)的VSEPR模型为______,其中心原子的轨道杂化方式为______;
(6)向硫酸铜溶液中逐滴加入氨水至得到蓝色透明溶液后,再加入极性较小的溶剂乙醇,析出深蓝色晶体![]() ,该晶体中配离子为____ ,配离子中的配位体为___ ,配位数为___。
,该晶体中配离子为____ ,配离子中的配位体为___ ,配位数为___。
【答案】Na+[:H]- ![]() 碳 1s22s22p2 2s22p2 Mn 四 ⅤⅡB d N>O>C NH4HCO3或者(NH4)2CO3 四面体型 sp3 Cu2+ NH3 4
碳 1s22s22p2 2s22p2 Mn 四 ⅤⅡB d N>O>C NH4HCO3或者(NH4)2CO3 四面体型 sp3 Cu2+ NH3 4
【解析】
(1)NaH是离子化合物,阴离子是H-,结构示意图为![]() ;
;
(2)根据原子核外电子的排列情况是:第一层排满了只能排2个电子,第二层排满了只能排8个电子,最外层不能超过8个电子分析;
(3)前四周期元素中,未成对电子数为5即外围电子排布图为3d54s2,原子序数为25,据此分析;
(4)C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素;根据组成离子化合物,则为铵盐,据此答题;
(5)SeO32-中心原子Se原子孤电子对数为![]() =1,价层电子对数=3+1=4;
=1,价层电子对数=3+1=4;
(6)NH3中N原子提供孤对电子,Cu2+提供空轨道,形成配位键,据此分析。
(1)NaH是离子化合物,阴离子是H-,NaH的电子式为Na+[:H]-,氢负离子的离子结构示意图为![]() ;
;
(2)原子核外电子的排列情况是:第一层排满了只能排2个电子,第二层排满了只能排8个电子,最外层不能超过8个电子,由某元素的原子最外层电子数是次外层电子数的2倍,所以该元素核外电子只能有两层,所以第一层是2,第二层是4,所以质子数是6,所以是碳元素,核外电子排布式为1s22s22p2,外围电子排布图为2s22p2;
(3)前四周期元素中,未成对电子数为5即外围电子排布图为3d54s2,原子序数为25即为Mn,该元素在周期表中的位置为第四周期,ⅤⅡB族,d区;
(4)C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能由大到小的顺序为N>O>C;由这三种元素和氢原子共同组成的离子化合物的化学式为NH4HCO3或者(NH4)2CO3;
(5)中心原子Se原子孤电子对数为![]() =1,价层电子对数=3+1=4,则中心原子的轨道杂化方式为sp3,SeO32-离子的VSEPR构型为四面体型;
=1,价层电子对数=3+1=4,则中心原子的轨道杂化方式为sp3,SeO32-离子的VSEPR构型为四面体型;
(6)NH3中N原子提供孤对电子,Cu2+提供空轨道,二者形成配位键,则该晶体中配离子为Cu2+,配离子中的配位体为NH3,配位数为4。


科目:高中化学 来源: 题型:
【题目】(1)汽车尾气是城市空气污染的一个重要因素,一种CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,在高温熔融状态下能传导O2-(过程中无气体产生),则负极的反应式为___。
(2)以上述电池为电源,通过导线连接成图一电解池。

①若X、Y为石墨,a为2L0.1mol/LKCl溶液,写出电解总反应的离子方程式___。
②若X、Y分别为铜、银,a为1L0.2mol/LAgNO3溶液,写出Y电极反应式___。
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图二(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。

①结合图二计算,上述电解过程中消耗一氧化碳的质量为___g。
②若图二的B点pH=7,则滴定终点在___区间(填“AB”、“BC”或“CD”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000mol·L-1 NaOH溶液滴定 20.00mL0.1000mol·L-1某一元酸HA溶液,滴定曲线如图。下列说法正确的是( )
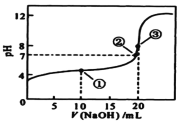
A. HA是强电解质
B. 点①所示溶液中:c(A-) >c(Na+)>c(H+) >c(OH-)
C. 点②所示溶液中:c(Na+) =c(HA) +c(A-)
D. 水的电离程度随着NaOH溶液的滴入,不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于溶液和胶体的叙述,不正确的是![]()
A.“海市蜃楼”既是一种自然现象又是光学现象,也与胶体的知识有关
B.欲制备![]() 胶体,将
胶体,将![]() 溶于水,搅拌即可
溶于水,搅拌即可
C.明矾净水时发生了化学变化和物理变化,但不起到杀菌、消毒的作用
D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
A.电池的电解质溶液为碱性溶液,阳离子向正极移动
B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mgL-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示):____________,该海水中Ca2+的物质的量浓度为__________mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。

① 开始时阳极的电极反应式为________________。
② 电解一段时间,____极(填“阴”或“阳”)会产生水垢,其成份为_____(填化学式)。
③ 淡水的出口为a、b、c中的__________出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示:

该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示_____(填粒子符号),充电时该电极反应式为_______。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为_________(空气中氧气的体积分数按20%计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应2A(g)![]() B(g)+C(g)的平衡常数为1,在容积为2 L的密闭容器中加入A(g)。20 s时测得各组分的物质的量如下表:
B(g)+C(g)的平衡常数为1,在容积为2 L的密闭容器中加入A(g)。20 s时测得各组分的物质的量如下表:
物 质 | A(g) | B(g) | C(g) |
物质的量/mol | 1.2 | 0.6 | 0.6 |
下列说法正确的是( )
A. 反应前20 s的平均速率为v(A)=0.6 mol·L-1·s-1
B. 20 s时,正反应速率等于逆反应速率
C. 达平衡时,A(g)的转化率为100%
D. 若升高温度,平衡常数变为0.6,则反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如下图所示。下列说法正确的是
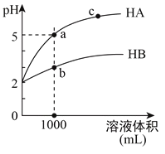
A.HA的酸性比HB的酸性弱
B.a点溶液的导电性比c点溶液的导电性强
C.若两溶液无限稀释,则它们的n(H+)相等
D.对a、b两点溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,CH3COOH的电离平衡常数为K,向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中正确的是( )

A. b点表示的溶液中c(Na+)>c(CH3COO﹣)
B. c点表示CH3COOH和NaOH恰好反应完全
C. d点表示的溶液中c(CH3COO﹣) c(H+)/c(CH3COOH)大于K
D. b、c、d三点表示的溶液中一定都存在:c(Na+)+c(H+)═c(CH3COO﹣)+c(OH﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com