
| A、NO2-酸性氧化物 Na2O2-碱性氧化物 Al2O3-两性氧化物 |
| B、汽油-混合物 胆矾-纯净物 金刚石-单质 |
| C、纯碱-碱 硫化氢-酸 小苏打-酸式盐 |
| D、液氯-非电解质 硫酸钡-强电解质 醋酸-弱电解质 |


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、充电时阳极反应式为:3Zn(OH)2+6e-═3Zn+6OH- |
| B、放电时OH-向正极移动 |
| C、充电时每转移3mol电子,阳极有1mol Fe(OH)3被还原 |
| D、放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、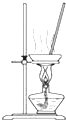 如图所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体 |
B、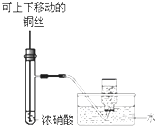 如图所示装置,制备并收集少量NO2气体 |
C、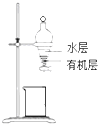 如图所示装置,分离CCl4萃取I2水后的有机层和水层 |
D、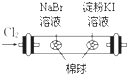 如图所示装置,可以证明氧化性:Cl2>Br2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- |
| B、向溴水中加入足量氯化亚铁溶液能使溴水变成无色 |
| C、能使pH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存 |
| D、向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和稀盐酸反应:Fe+2H+═Fe2++H2↑ |
| B、碳酸钙溶于醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O |
| C、硫酸溶液中加入碳酸氢钠溶液:H++HCO3-═CO2↑+H2O |
| D、在氢氧化钾的稀溶液中通过量的二氧化碳气体:CO2+OH-═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:1 | B、1:3 |
| C、1:2 | D、2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com