
【题目】以下是由乙烯合成乙酸乙酯的几种可能的合成路线:

(1)乙烯中官能团的结构简式是___,乙醇中含氧官能团的名称是____。
(2)请写出上述几种路线中涉及到的有机化学反应基本类型,反应①:____,反应②:____。
(3)请写出④、⑤反应的化学方程式:
④__________________________;
⑤____________________________。
(4)乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用下列装置来制备。完成下列填空:

①实验时,加入药品的顺序是____,该反应进行的比较缓慢,为了提高反应速率,一般要加入浓硫酸做催化剂,并____。
②反应结束后,将试管中收集到的产品倒入分液漏斗中,____、静置,然后分液。
③若用b装置制备乙酸乙酯,其缺点有____(答一条即可)。
【答案】 ![]() 羟基 加成反应 氧化反应 2CH3CH2OH+O2
羟基 加成反应 氧化反应 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3CH2OH+CH3COOH
2CH3CHO+2H2O CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O 乙醇、浓硫酸、乙酸 加热 振荡 原料损失较大或易发生副反应等
CH3COOCH2CH3+H2O 乙醇、浓硫酸、乙酸 加热 振荡 原料损失较大或易发生副反应等
【解析】由合成流程可知,①为乙烯与水的加成反应生成乙醇,②为乙烯的氧化反应生成乙醛,③为乙烯的氧化反应生成乙酸,④为乙醇的氧化反应生成乙醛,⑤为乙醇与乙酸的酯化反应生成乙酸乙酯,以此来解答;
(4)①为防止酸液飞溅,应先加入乙醇,然后再加入浓硫酸和乙酸;该反应进行的比较缓慢,为了提高反应速率,一般要加入浓硫酸做催化剂,并加热;
②乙酸乙酯与饱和碳酸钠溶液分层,应充分振荡后静置分层;
③图b直接加热时乙醇、乙酸易挥发,且乙醇可发生分子间脱水反应,而图a中水浴加热可控制温度,以此来解答。
(1)乙烯中含有碳碳双键,结构简式为![]() ;乙醇中含氧官能团的名称是羟基;
;乙醇中含氧官能团的名称是羟基;
(2)根据以上分析可知反应①是加成反应,反应②是氧化反应;
(3)反应④的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;反应⑤的方程式为CH3CH2OH+CH3COOH
2CH3CHO+2H2O;反应⑤的方程式为CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(4)①浓硫酸溶于水放热,密度大于水,为防止酸液飞溅,应先加入乙醇,然后再加入浓硫酸和乙酸,如先加浓硫酸会出现酸液飞溅的可能现象;该反应进行的比较缓慢,为了提高反应速率,一般要加入浓硫酸做催化剂,并加热;
②反应结束后,将试管中收集到的产品倒入分液漏斗中,振荡、静置,然后分液;
③若用b装置制备乙酸乙酯,其缺点有原料损失较大、易发生副反应等。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】[化学-选修5:有机化学基础]2017年治疗膀胱癌的有机小分子药物Aminolevulinic acid被批准使用,其合成路线如下:

已知:
请回答:
(1)A的名称为________,G中含氧官能团的名称为____________________________。
(2)⑤的反应类型为____________________,H的分子式为_____________________________。(3)①的化学方程式为__________________________________________。
(4)④的化学方程式为______________________________________________。
(5)D的同分异构体中,同时满足下列条件的共有____种(不含立体异构);
a.能与Na反应产生气体
b.既能发生银镜反应,又能发生水解反应
其中核磁共振氧谐有4组峰的物质的结构简式为________________(任写一种)。
(6)参照上述合成路线,设计由2-甲基丙酸和甲醇为起始原料制备2-甲基丙烯酸甲酯的合成路线(无机试剂任选)______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)CO(g)+2H2(g)CH3OH(g)△H
如表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H0(填“>”、“=”或“<”).能够说明某温度下该反应是平衡状态的是
A.体系的压强不变 B.密度不变 C.混合气体的相对分子质量 D.c(CO)=c(CH3OH)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=(保留3为有效数字)
(2)在某温度和压强下,将一定量H2和O2充入密闭容器发生反应:
2H2(g)+O2(g)2H2O(g)△H=﹣241.8KJ/mol,平衡后压缩容器体积至原来的 ![]() ,其他条件不变,对平衡体系产生的影响是 (填序号):
,其他条件不变,对平衡体系产生的影响是 (填序号):
a.平衡常数K增大; b.正反应速率加快,逆反应速率减慢; c.重新平衡c(H2)/c(H2O)减小.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,HCl作氧化剂的是( )
A.NaOH+HCl=NaCl+H2O
B.Zn+2HCl=ZnCl2+H2↑
C.MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.CuO+2HCl=CuCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是
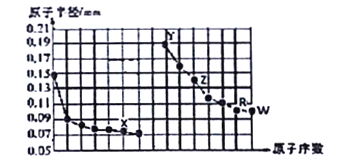
A. X所在主族中,X的简单氢化物分子间存在氢键,所以其氢化物稳定性最强
B. R简单氢化物的酸性弱于W简单氢化物,故元素非金属性R小于W
C. 在同周期中,W的含氧酸酸性最强
D. 已知Z的一种金属储氢材料LiZH4(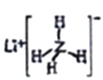 )遇水剧烈反应放出H2,则反应方程式为:LiZH4+2H2O=LiZO2+4H2↑
)遇水剧烈反应放出H2,则反应方程式为:LiZH4+2H2O=LiZO2+4H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述不正确的是( )

A. 铜电极上发生还原反应
B. 电池工作一段时间后,c(SO42-)向锌电极移动,甲池的c(SO42-)增大
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 电流的方向:由铜电极经过导线流向锌电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国里昂的科学家最近发现一种只由四个中子组成的微粒,这种微粒称为“四中子”,也有人称之为“零号元素”.它与天体中的中子星构成类似.有关:“四中子”微粒的说法正确的( )
A.该微粒的质量数为2
B.该微粒不显电性
C.它与普通中子互称为同位素
D.在元素周期表中与氢元素占同一位置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素。已知:
① Q为元素周期表中原子半径最小的元素;
② R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③ Y的基态原子的核外成对电子数是未成对电子数的3倍;
④ Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示):
(1)Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,化合物M的空间构型为____________,其中心原子采取_______杂化;Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂,化合物N在固态时的晶体类型为____。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为________________。
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为_____(写分子式)。
(4)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质,该反应的离子方程式为_________________________。
(5)某含Z配合物,化学式为[ZCl(H2O)5]Cl2, 配位数为____,1 mol该配合物中![]() 键的数目为___。
键的数目为___。
(6)Z原子基态时的价电子排布式为__________;已知Z的一种含氧酸钡盐的密度为ρ g.cm-3,其晶胞的结构如图所示,则晶体中氧原子与钡原子的最近距离为_______cm。(只要求列算式,不必计算出数值。阿伏伽德罗常数为NA)
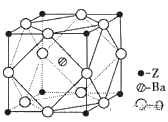
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com