
【题目】实验室从含碘废液![]() 除
除![]() 外,含有
外,含有![]() 、
、![]() 、
、![]() 等
等![]() 中回收碘,其实验过程如下:
中回收碘,其实验过程如下:
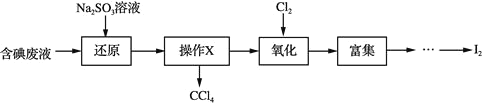
下列叙述不正确的是
A.“还原”步骤发生的反应为:![]()
![]()
B.“操作X”为静置、分液,所得![]() 可用作“富集”的萃取剂
可用作“富集”的萃取剂
C.“氧化”过程中,为使![]() 完全被氧化,需长时间通入
完全被氧化,需长时间通入![]()
D.“富集”即![]() 富集于有机溶剂,同时除去某些杂质离子
富集于有机溶剂,同时除去某些杂质离子
 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】今有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)


(1)写出①~④的仪器名称:①__________,②__________,③________,④________。
(2)实验室制取并收集氧气时应选择________和________相连接,制取并收集氢气时应选择________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是________。
(4)制取氢气并做还原氧化铜的实验,应选择________和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
则常温常压下,NH3与NO2反应生成无污染物质的热化学方程式_____________。
(2)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图所示:
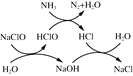
写出该图示的总反应化学方程式:__________________。该反应需控制温度,温度过高时氨氮去除率降低的主要原因是______________。
②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如图所示:
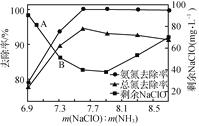
当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是___。
(3)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如图所示:
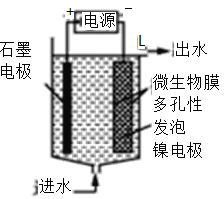
①写出该活性原子与NO3-反应的离子方程式:________________。
②若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有新合成的一种烃,其碳骨架呈三棱柱体(如图所示,碳碳键的键长相等)。
![]()
(1)写出该烃的分子式:________________。
(2)该烃的一氯代物有________种。
(3)该烃的四氯代物有________种。
(4)该烃的同分异构体有多种,其中一种不能使酸性高锰酸钾溶液褪色,但在一定条件下能跟液溴、氢气等发生反应,这种同分异构体的结构简式为________________。请写出该同分异构体与氢气反应的化学方程式并注明反应类型:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】列关于古籍中的记载说法正确的是( )
A.直径为20 nm的纳米碳酸钙属于胶体
B.氢化钙的电子式是:Ca2+[∶H]2-
C.“千锤万凿出深山,烈火焚烧若等闲。”这句古诗包含了吸热反应过程
D.《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入润洗过的锥形瓶中,并加入1或2滴酚酞溶液
⑤滴入一滴标准液后,溶液颜色由无色变为红色立即停止滴定,记录液面读数
请回答:

(1)以上步骤有错误的是(填编号)________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入______中。(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:______(填编号)
A 酸式滴定管未润洗
B 滴定前,滴定管尖嘴无气泡,滴定后有气泡
C 锥形瓶先用蒸馏水洗涤后,未用待测液润洗
D 滴定结束时仰视滴定管,并记录数据
E 滴定过程中有一滴标准液飞溅出锥形瓶
(4)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_______________。
II.利用中和滴定的原理,在工业生产中还可以进行氧化还原滴定测定物质含量。
(5)水泥中钙经处理得草酸钙沉淀经稀H2SO4处理后,用![]() 标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反为:
标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反为:![]() .实验中称取0.400g水泥样品,滴定时消耗了0.0500 mol·L-1的
.实验中称取0.400g水泥样品,滴定时消耗了0.0500 mol·L-1的![]() 溶液36.00 mL,则该水泥样品中钙的质量分数为__________
溶液36.00 mL,则该水泥样品中钙的质量分数为__________
(6)滴定终点的现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜![]() 是有机合成中应用广泛的催化剂。它微溶于水,不溶于乙醇,露置于潮湿的空气中易被氧化,但在干燥的空气中稳定,见光会分解。实验室制备CuCl的过程如下:
是有机合成中应用广泛的催化剂。它微溶于水,不溶于乙醇,露置于潮湿的空气中易被氧化,但在干燥的空气中稳定,见光会分解。实验室制备CuCl的过程如下:
Ⅰ、检査图装置气密性,依次向三颈瓶中加入铜丝、![]() 、
、![]() 、HCl,关闭K;
、HCl,关闭K;
Ⅱ、加热至![]() 时停止加热,铜丝表面产生无色气泡,液面上方气体逐渐变为红棕色,气囊鼓起;
时停止加热,铜丝表面产生无色气泡,液面上方气体逐渐变为红棕色,气囊鼓起;
Ⅲ、打开K,通入![]() ,待气囊变瘪、瓶内红棕色气体消失时关闭K,冷却至室温,制
,待气囊变瘪、瓶内红棕色气体消失时关闭K,冷却至室温,制![]()
Ⅳ、将液体转移至烧杯中用足量蒸馏水稀释,产生白色沉淀,过滤得CuCl粗品和滤液;
Ⅴ、粗品用![]() 乙醇洗涤、烘干得CuCl。
乙醇洗涤、烘干得CuCl。
请回答下列问题:
⑴实验室中CuC1的保存方法是______
⑵通入![]() 的目的是______,为便于观察和控制产生
的目的是______,为便于观察和控制产生![]() 的速率,制备
的速率,制备![]() 的装置最好选用______
的装置最好选用______![]() 填字母
填字母![]()
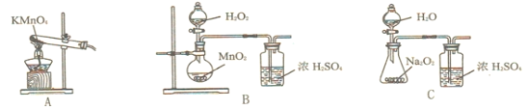
⑶①三颈瓶中生成![]() 的总反应的离子方程式为______
的总反应的离子方程式为______
②步骤Ⅳ中产生白色沉淀的化学方程式为______
⑷步骤V中洗涤时试剂选用![]() 乙醇的原因是______
乙醇的原因是______
⑸![]() 纯度测定:称取样品
纯度测定:称取样品![]() 置于预先放入玻璃珠30粒和10mL过量的
置于预先放入玻璃珠30粒和10mL过量的![]() 溶液的锥形瓶中,不断摇动;待样品溶解后,加水50mL和指示剂2滴;立即用
溶液的锥形瓶中,不断摇动;待样品溶解后,加水50mL和指示剂2滴;立即用![]() 硫酸铈标准溶液滴定至终点并记录读数,再重复实验两次,测得数据如表所示。(已知:
硫酸铈标准溶液滴定至终点并记录读数,再重复实验两次,测得数据如表所示。(已知:![]() ,
,![]() )
)
实验序号 | 1 | 2 | 3 |
滴定起始读数 |
|
|
|
滴定终点读数 |
|
|
|
![]() 玻璃珠的作用______
玻璃珠的作用______
![]() 的纯度为______
的纯度为______![]() 保留三位有效数字
保留三位有效数字![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)“民以食为天,食以安为先”。近年来屡屡发生的 劣质奶粉、苏丹红、多宝鱼等食品安全事件严重威胁消费者的健康和生命安全。下列有关蛋白质的说法正确的是____________(填序号)。
A.蛋内质是重要的营养物质,也是提供人体所需能最的主要物质
B.蛋白质在淀粉酶的作用下,可水解成葡萄糖等
C.蛋白质水解的最终产物是氨基酸
(2)奶粉中蛋内质含量的国家标准是:每100 g婴幼儿奶粉中含蛋白质1225 g。其测定方法是:奶粉经水解产生氨基酸,再经过其他反应生成氨, 由氨的量计算出氮的量,再由氮的量求出蛋白质的含量(蛋白质含氮量按16%计算)。某市质检局取100 g市场中的某个品牌的奶粉样品进行检验。该样品进行反应后生成的![]() 和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉__________(填“属于”或“不属于”)合格奶粉。
和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉__________(填“属于”或“不属于”)合格奶粉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L的密闭容器中加入1mol X、0.3molZ和一定量的Y三种气体,一定条件下发生反应,各物质的浓度随时间变化如图一所示,图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是
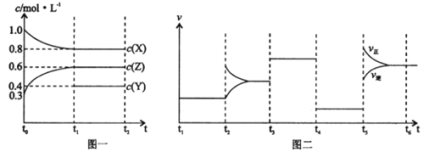
A.Y的起始物质的量为0.5mol
B.该反应化学方程式为:2X(g)+Y(g)![]() 3Z(g) ΔH<0
3Z(g) ΔH<0
C.若t0=0,t1=10min,则t0~t1阶段的平均反应速率为v(Z)=0.03mol·(L·min)-1
D.反应物X的转化率t6点比t3点高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com