
【题目】下列说法正确的是( )
A.形成离子键的阴、阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第3周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种元素,它们的核电荷数依次增多。
①A的核电荷数大于2,其气态氢化物H2A在常温下是液体;
②A和B两元素可形成化合物B2A3,该化合物既能溶于酸,又能溶于强碱;
③C+比B3+多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于C的下两个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2∶1。试回答:
(1)E是___________ (写元素符号)。
(2)B的离子结构示意图是:___________,D的单质分子的结构式:___________,C元素最高价氧化物对应的水化物的电子式:___________。
(3)化合物H2A的性质比较特殊,同温同压下其晶体(固体)密度较液体小。试解释原因:_________________________________。
(4)B2A3与强碱反应的离子方程式为____________________________,根据②我们可以推测出化合物B2A3的性质是:两性偏______(填“酸性”、“碱性”或“中性”)。
(5)B、C、E三种元素的金属性按照由强到弱的顺序排列应为:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸是有机合成中一种有用的中间体。某研究小组以丙烯醛为原料,设计了如下路线合成环丁基甲酸(部分反应条件、产物巳省略)。
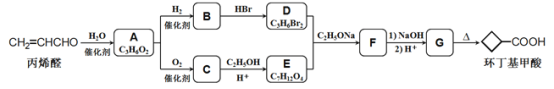
已知:
请回答下列问题:
(1)由丙烯醛生成化合物A的反应类型为____________
(2)化合物C的结构简式是________________________
(3)下列说法中不正确的是____________(填字母代号)。
A.化合物A能与 NaHCO3溶液反应
B.化合物B和C能形成高聚物
C.化合物G的化学式为C6H8O4
D.1mol化合物B与足量金属钠反应能牛成1mol氢气
(4)写出D+E→F的化学方程式:___________________________________
(5)环丁基甲酸与苯酚反应生成一种酯X,化合物X满足下列条件的所同分异构体有____________种,写出其中一种的结构简式:________________________
①能使FeCl3溶液变紫色;
②含有丙烯醛中所有的官能团;
③1H-NMR谱显示分子中含有5种不同化学环境的氢原子
(6)以1,3-丁二烯和化合物E为原料可制备环戊基甲酸![]() ,请选用必要的试剂设计合成路线____________________________________________________________
,请选用必要的试剂设计合成路线____________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.化学平衡常数是受溶液的浓度、气体的压强、体系的温度等外界条件影响的
B.某电解质溶液中,温度升高,Kw增大,则溶液的酸性或碱性一定增强
C.H2CO3的电离常数表达式:K= ![]()
D.电离平衡常数可以表示弱电解质的相对强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向0.1mol·L-1H3PO4溶液中加入NaOH的过程中各种微粒的物质的量分数随pH的变化关系如图所示(H3PO4)的三级电离常数依次为Ka1、Ka2、Ka3、pK=-lgK)。下列叙述错误的是

A. pKa1=2.16
B. 溶液呈中性时,[H2PO4-]>[HPO42-]
C. 反应PO43-+H2O![]() HPO42-+OH-的pK=1.68
HPO42-+OH-的pK=1.68
D. Na2HPO4溶液中存在[OH-]+[PO43-]=[H+]+[H2PO4-]+[H3PO4]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列事实的解释正确的是( )
A.SO2能使KMnO4溶液褪色,不能说明SO2具有漂白性
B.向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有吸水性
C.用HF来刻蚀玻璃,说明SiO2是碱性氧化物
D.雨水显酸性是因为吸收了空气中的CO2,pH小于7的雨水称为酸雨
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com