
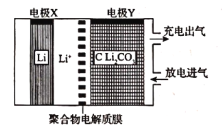
【题目】利用锂电池“固定![]() ”的电化学装置如图所示,在催化剂的作用下,该电化学装置放电时可将
”的电化学装置如图所示,在催化剂的作用下,该电化学装置放电时可将![]() 转化为
转化为![]() 和
和![]() ,充电时选用合适的催化剂,只有
,充电时选用合适的催化剂,只有![]() 发生氧化反应,释放出
发生氧化反应,释放出![]() 和
和![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.该电池放电时,![]() 向电极
向电极![]() 方向移动
方向移动
B.该电池充电时,每转移![]() 的电子,理论上阳极产生
的电子,理论上阳极产生![]()
C.该电池放电时,每转移![]() 电子,理论上有
电子,理论上有![]() 参加反应
参加反应
D.该电池充电时,阳极电极反应式为![]()
【答案】C
【解析】
放电时,X极上Li失电子,则X为负极,Y为正极,正极上CO2得电子生成C和Li2CO3,反应式为:3CO2+4Li++4e-═C+2Li2CO3;充电时,选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2,据此分析。
A.放电时,X极上Li失电子,则X为负极,Y为正极,放电时阳离子向正极移动,即Li+向电极Y方向移动,故A错误;
B.该电池充电时,选用合适的催化剂,只有![]() 发生氧化反应,释放出
发生氧化反应,释放出![]() 和
和![]() ,阳极的电极反应为2Li2CO3-4e-=4Li++2CO2↑+O2↑可知,每转移0.4mol电子,理论上阳极产生0.2molCO2,题干中没有注明标准状况,无法计算体积,故B错误;
,阳极的电极反应为2Li2CO3-4e-=4Li++2CO2↑+O2↑可知,每转移0.4mol电子,理论上阳极产生0.2molCO2,题干中没有注明标准状况,无法计算体积,故B错误;
C.放电时,正极上CO2得电子生成C和Li2CO3,即3CO2+4Li++4e-═C+2Li2CO3,则每转移4mol电子,理论上有3molCO2参加反应,故C正确;
D.该电池充电时,选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2,阳极的电极反应为2Li2CO3-4e-=4Li++2CO2↑+O2↑,故D错误;
答案为C。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
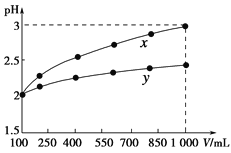
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s) ![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+ △H>0。
CH3COO-+H+ △H>0。
(1)下列方法中,可以使0.10 mol/L CH3COOH的电离程度增大的是_______(用序号填写)。
a.加入少量0.10 mol/L的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol/L d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol/L的NaOH溶液
(2)将等质量的锌粒投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积关系为V(盐酸)_____V(醋酸)(填写“>”、“<”或“=").
(3)常温下,向体积为VamL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液VbmL至溶液恰好呈中性,则Va与Vb的关系为: Va______Vb(填写“>”、“<”或“=”)。
(4)已知: 某温度时,水的离子积常数为Kw=1.0×10-12,在此温度下,将pH=1的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=_______mol/L。
Ⅱ.结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 | H2C2O4 | K1=5.4×10-2 | H2S | K1=1.3×10-7 |
HClO | 3×10-8 | K2=4.7×10-11 | K2=5.4×10-5 | K2=7.1×10-15 |
请回答下列问题:
(1) 同浓度的CH3COO-、HCO3/span>-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是_________。
(2) 0.1mo1/L的H2C2O4溶液与0.1mo1/L的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为________________。
(3)pH相同的NaC1O和CH3COOK溶液中,[c(Na+)-c(C1O-)]______[c(K+)-c(CH3COO-)](填“>”、“<”或“=”) 。
(4) 向0.1mo1/LCH3COOH 溶液中滴加NaOH 溶液至c(CH3COOH): c(CH3COO-)=5:9,此时溶液pH=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组为了验证元素非金属性递变规律,设计了如图所示的两套实验方案进行实验探究:
(1)根据方案一装置![]() 如图
如图![]() 回答以下问题:
回答以下问题:
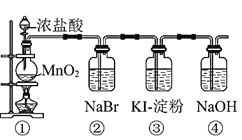
Ⅰ![]() 写出装置①中发生反应的化学方程式:______。
写出装置①中发生反应的化学方程式:______。
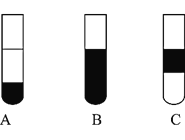
Ⅱ![]() 若将反应后②中的溶液倒入
若将反应后②中的溶液倒入![]() 中,出现的现象与图中吻合的是______。
中,出现的现象与图中吻合的是______。![]() 填代号
填代号![]()
Ⅲ![]() 装置③中的现象是______。
装置③中的现象是______。
(2)根据方案二装置![]() 如图
如图![]() 回答以下问题:
回答以下问题:

Ⅰ![]() 方案二验证元素非金属性递变的理论依据是:______。
方案二验证元素非金属性递变的理论依据是:______。
Ⅱ![]() 装置的作用是______,X是______。
装置的作用是______,X是______。
Ⅲ![]() 能说明碳元素与硅元素非金属性强弱的实验现象是______。
能说明碳元素与硅元素非金属性强弱的实验现象是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物。
试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______。
(2)D元素位于周期表中______周期___________族。
(3)写出AB2与C2B2反应的化学方程式________________________________________________。
(4)画出B的原子结构简图 ___________________。
(5)用电子式表示化合物 C2D 的形成过程:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成,下列说法不正确的是( )

A.Y的分子式为C10H8O3
B.制备过程中发生的反应类型有消去反应、取代反应
C.由X制取Y的过程中可得到乙醇
D.等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL x mol·L-1 CH3COOH溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图所示(忽略温度变化)。下列说法中不正确的是( )
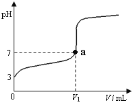
A. 上述 CH3COOH溶液中:c(H+)=1×10-3 mol·L-1
B. 图中V1 <20 mL
C. a点对应的溶液中:c (CH3COO-)=c (Na+)
D. 当加入NaOH溶液的体积为20 mL时,溶液中:c (CH3COOH) + c (H+)>c (OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com