
| A、.①③ | B、.③④ |
| C、.②③ | D、①④ |


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
| A、工业上通过电解熔融的氯化钠来制取金属钠 |
| B、钠投入到硫酸铜溶液中有大量的铜析出 |
| C、钠钾合金可在中子反应堆中作热交换剂 |
| D、钠可用于从钛、铌等金属的氯化物中置换出金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径 (10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
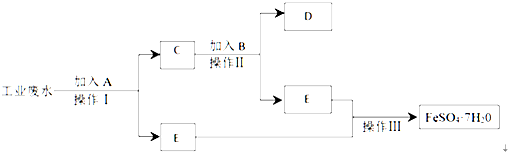
查看答案和解析>>
科目:高中化学 来源: 题型:
| 配料 | 氯化钠、碘酸钾 |
| 含碘量 | (40~50)mg/kg(以I计) |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、避光、密封、防潮 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-H | 414 | C-F | 489 | H-F | 565 |
| H-H | 436 | H-N | 391 | F-F | 158 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸和食醋既是化合物又是酸 |
| B、凡是生成两种或两种以上物质的反应都是分解反应 |
| C、氯化钠和HCl溶于水都发生电离,克服粒子间作用力相同 |
| D、一种元素可能有多种氧化物,且一种化合价可能对应不止一种氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com