
【题目】下列实验对应的现象及结论均正确,且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 室温下,用pH试纸分别测定浓度均为0.1mol·L-1NaClO溶液和CH3COONa溶液的pH | NaClO溶液的pH大于CH3COONa溶液 | HClO的酸性比CH3COOH的酸性弱 |
B | 向盛有2mL0.1mol·L-1AgNO3溶液的试管中滴加5滴0.1mol·L-1Na2CO3溶液,再往试管中滴加几滴0.1mol·L-1Na2S溶液 | 先出现白色沉淀,后沉淀变为黑色 | Ksp(Ag2CO3)>Ksp(Ag2S) |
C | 石灰石与浓盐酸混合共热,将所得气体通入苯酚钠溶液 | 溶液变浑浊 | 碳酸的酸性比苯酚强 |
D | 向2mL0.01mol·L-1的KI溶液中滴入等体积等浓度的FeCl3溶液,将充分反应后的溶液分成三份,第一份滴入K3[Fe(CN)6]溶液,第二份滴入KSCN溶液,第三份滴入淀粉溶液 | 滴入K3[Fe(CN)6]溶液后产生蓝色沉淀;滴入KSCN溶液后溶液变红色;滴入淀粉溶液后溶液变蓝色 | KI溶液和FeCl3溶液发生反应:2Fe3++2I- |
A.AB.BC.CD.D
【答案】D
【解析】
A.NaClO溶液具有强氧化性,可使pH试纸褪色,无法用pH试纸测出NaClO溶液的pH,A错误;
B.由于试管中的AgNO3溶液过量,加入Na2CO3后AgNO3还有较大量的剩余,故再加Na2S溶液会直接与过量的AgNO3反应生成黑色的Ag2S沉淀,不会有白色沉淀转化为黑色沉淀的现象,B错误;
C.由于盐酸易挥发,苯酚钠溶液变浑浊可能是由于挥发的HCl造成的,不能证明碳酸的酸性比苯酚强,C错误;
D.根据滴入K3[Fe(CN)6]溶液后产生蓝色沉淀以及滴入淀粉溶液后溶液变蓝色可以知道反应后溶液中有亚铁离子和碘单质,根据滴入KSCN溶液后溶液变红色的现象可知反应后溶液中仍然含有铁离子,所以结论为铁离子能够氧化碘离子,且该反应为可逆反应,即KI溶液和FeCl3溶液发生反应:2Fe3++2I-![]() 2Fe2++I2,D正确;
2Fe2++I2,D正确;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】随着各地“限牌”政策的推出,电动汽车成为汽车界的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图所示。其中 A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导 Li+的高分子材料,隔膜只允特定的离子通过,电池反应式为:LixC6+Li1-xCoO2![]() C6+LiCoO2。下列说法不正确的是( )
C6+LiCoO2。下列说法不正确的是( )

A. 该隔膜只允许 Li+通过,放电时 Li+从左边流向右边
B. 放电时,正极锂的化合价未发生改变
C. 充电时 B 作阳极,该电极放电时的电极反应式为 Li1-xCoO2+xLi++xe-=LiCoO2
D. 废旧钴酸锂(LiCoO2)电池进行“放电处理”让 Li+进入石墨中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述错误的是
A. 将过量氨气通入CuSO4溶液中可得深蓝色溶液
B. 蛋白质溶于水所得分散系可产生丁达尔效应
C. 硅酸钠溶液与稀盐酸反应可生成硅酸胶体
D. 过量铁粉在氯气中燃烧可生成氯化亚铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
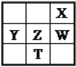
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电子式表示下列化合物:
(1)NaCl _____。
(2)H2 ______。
(3)MgCl2 ______。
(4)CH4 ______。
(5)CO2 ______。
(6)Na2O ______。
把其中只含共价键的物质的电子式改成结构式: ______、 ______、 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g) H=+11 kJ·mol-1。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g) H=+11 kJ·mol-1。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |

由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当改变条件,再次达到平衡时,下列有关叙述不正确的是( )
A.若升高温度到某一温度,再次达到平衡时,相应点可能分别是A、E
B.若改变的条件是增大压强,再次达到平衡时,相应点与改变条件前相同
C.若改变的条件是使用催化剂,再次达到平衡时,相应点与改变条件前不同
D.若再次充入a mol HI,则达到平衡时,相应点的横坐标值不变,纵坐标值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是( )
A.原子序数:Y>X>Z>WB.离子半径:X+>Y2+>Z->W2-
C.原子最外层电子数:Z>W>Y>XD.还原性:X>Y,W2->Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用盐酸的质量分数为36.5%,密度为1.20 g·mL-1。
(1)此浓盐酸中HCl的物质的量浓度是________。
(2)配制100 mL该浓盐酸,需要标准状况下HCl的体积为________。
(3)配制100 mL 3.00 mol·L-1的盐酸,需以上浓盐酸的体积为________。
(4)将10.0 mL 3.00 mol·L-1的盐酸与10.0 mL 1.00 mol·L-1的MgCl2溶液混合,则混合溶液中Cl-的物质的量浓度是________。(设混合后溶液的体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

下列说法正确的是 ( )
A. 自然界中存在大量的单质硅
B. 步骤电弧炉中的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com