
【题目】某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现下图所示的物质之间的转化:
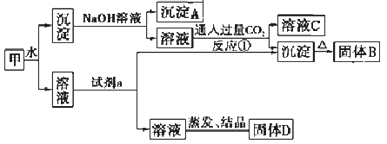
请回答下列问题:
(1)写出A、B的化学式:A________ B_________。
(2)试剂a最好选用下列试剂中的_________。
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
请写出相应的离子方程式___________。
(3)写出反应①(生成溶液C和沉淀)的离子方程式_________。
(4)固体D可以作为复合性的化学肥料,D中所含物质的化学式为_________。
【答案】 Fe2O3 Al2O3 D Al3+ + 3NH3·H2O == Al (OH)3 ↓+3NH4+ AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- K2SO4和 (NH4)2SO4
【解析】混合物甲中加水,KAl(SO4)2·12H2O溶于水变为溶液,而Al2O3和Fe2O3不溶于水,沉淀中加入氢氧化钠溶液,Al2O3变为偏铝酸钠溶液,而Fe2O3与碱不反应变为沉淀A;偏铝酸钠溶液通入足量的二氧化碳,生成氢氧化铝沉淀和碳酸氢钠溶液C,氢氧化铝沉淀加热分解为氧化铝B;KAl(SO4)2溶液加入氨水生成氢氧化铝沉淀和硫酸钠和硫酸铵溶液,蒸发结晶后得到二者的固体。
(1)综上分析可知:A为Fe2O3、B为Al2O3;正确答案: Fe2O3、Al2O3。
(2)铝离子与氢氧化钠溶液需要控制用量才能生成氢氧化铝沉淀,铝离子与足量的氨水反应生成氢氧化铝沉淀,试剂a最好选氨水,反应的离子方程式:Al3+ + 3NH3·H2O == Al (OH)3 ↓+3NH4+;正确答案:D;Al3+ + 3NH3·H2O == Al (OH)3 ↓+3NH4+。
(3)偏铝酸钠溶液通入足量的二氧化碳,生成氢氧化铝沉淀和碳酸氢钠溶液,离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;正确答案:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-。
(4)KAl(SO4)2溶液加入氨水生成氢氧化铝沉淀和硫酸钠和硫酸铵溶液,蒸发结晶后得到二者的固体。化学肥料含有氮元素、钾元素,因此K2SO4和 (NH4)2SO4可以作为复合性的化学肥料,正确答案:K2SO4和 (NH4)2SO4。


科目:高中化学 来源: 题型:
【题目】海水中有非常丰富的化学资源,从海水中可提取多种化工原料。某工厂对海水资源综合开发利用的部分工艺流程图如下。回答下列问题:

(1)精制食盐水时下列物质中,用到的有______________________(填序号)。
①NaOH溶液 ②盐酸 ③K2CO3溶液 ④BaCl2溶液 ⑤硫酸 ⑥Na2CO3溶液 ⑦Ba(NO3)2溶液
(2)工业上经过②、③、④制备Ba2。步骤②中Cl2氧化Br-应在________(填酸性或碱性)条件下进行;步骤③Br2可用热空气吹出,其原因是_____________________。
(3)为了除去工业Br2中微量的Cl2,可向工业Br2中____________________。
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
(4)若步骤⑤所得Mg(OH)2沉淀中混有Ca(OH)2杂质,写出除去杂质的实验步骤 ________________(写出加入的试剂和操作)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有24mL浓度为0.05mol·L-1的Na2SO3溶液恰好与20mL浓度为0.02mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
A.+2B.+3C.+4D.+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有pH为13的Ba(OH)2、NaOH的混合液100mL,从中取出24mL.用0.025mol/LH2SO4滴定,当滴定至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半.求:①当滴到沉淀不再增加时(溶液体积变化忽略不计),溶液的pH=________(已知:lg2=0.3).
②原混合溶液中c[Ba(OH)2]=________和c(NaOH)=________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类,例如:

(1)上图所示的物质分类方法名称是_____________。
(2)以K、Na、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②、④、⑥后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②____ | ③NaOH ④___ | ⑤Na2SO4 ⑥____ | ⑦SO2 ⑧SO3 | ⑨NH3 |
(3)写出⑦转化为⑧的化学方程式_________________。
(4)写出单质Al与③溶液反应的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原是一类重要的反应。
(1)已知反应2I-+2Fe3+=I2+2Fe2+,反应中还原剂是_________,氧化性Fe3+______I2 (填“ < ”或“ > ”) 。
(2)在2Na2O2+2CO2=2Na2CO3+O2反应中,若转移3mol电子,则所产生的氧气在标准状况下的体积为___________L。
(3)在xR2++yH++O2═mR3++nH2O的离子方程式中,对系数m和R2+、R3+判断正确的是__。
A.m=y,R3+是还原剂 B.m=2y,R2+被氧化
C.m=2,R3+是氧化剂 D.m=4,R2+是还原剂
(4)用双线桥标出反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中电子转移的方向和数目_________。
(5)氯气和石英砂、碳粉共热可发生反应:SiO2+2C+2Cl2![]() SiCl4+2CO当反应消耗6g碳时,生成还原产物_________mol。
SiCl4+2CO当反应消耗6g碳时,生成还原产物_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5依次发生的分解反应为:
①N2O5(g)N2O3(g)+O2(g)
②N2O3(g)N2O(g)+O2(g)
在容积为2L的密闭容器中充入8mol N2O5 , 加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol.则t℃时反应①的平衡常数为( )
A.10.7
B.8.5
C.9.6
D.10.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=﹣lg c(M),pCO32﹣=﹣lg c(CO32﹣).下列说法不正确的是( ) 
A.MgCO3、CaCO3、MnCO3 的Ksp依次减小
B.a 点可表示MnCO3 的饱和溶液,且c(Mn2+)=c(CO32﹣)
C.b 点可表示的CaCO3不饱和溶液,且c(Ca2+)<c(CO32﹣)
D.c 点可表示MgCO3 的不饱和溶液,且c(Mg2+)<c(CO32﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是( )
A. 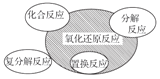 四种基本反应类型与氧化还原反应的关系
四种基本反应类型与氧化还原反应的关系
B.  AlCl3溶液中滴加NaOH溶液生成沉淀的情况
AlCl3溶液中滴加NaOH溶液生成沉淀的情况
C.  Ba(OH)2溶液中滴加硫酸溶液导电性的情况
Ba(OH)2溶液中滴加硫酸溶液导电性的情况
D.  等体积、等浓度稀硫酸分别与足量铁和镁反应的情况
等体积、等浓度稀硫酸分别与足量铁和镁反应的情况
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com