
【题目】下列实验操作能达到目的的是( )

A.用灼烧的方法鉴别棉麻与真丝
B.加入浓溴水除去苯中溶解的杂质苯酚
C.用图甲装置制取并收集乙酸乙酯
D.用图乙装置验证溴乙烷与NaOH醇溶液共热产生了乙烯
【答案】A
【解析】
A.真丝中含有蛋白质,灼烧产生烧焦羽毛的气味,棉麻中主要含有纤维素,灼烧时则没有特殊气味,可以鉴别,故A实验方法能达到实验目的;
B.苯酚与溴反应生成的三溴苯酚,三溴苯酚溶于苯,无法用浓溴水除去苯中的苯酚,可以用氢氧化钠溶液洗涤混合物,故B实验方法不能达到实验目的;
C.乙醇和乙酸在浓硫酸作催化剂加热条件下发生酯化反应制取乙酸乙酯,乙酸乙酯中混有挥发的乙酸和乙醇,用饱和碳酸钠溶液进行除杂与收集,乙酸乙酯属于酯类,与氢氧化钠溶液发生水解反应,不能用于收集乙酸乙酯,故C实验方法不能达到实验目的;
D.溴乙烷与NaOH乙醇溶液共热发生消去反应产生了乙烯,但乙醇具有挥发性,制得的乙烯中混有乙醇,乙醇也能被酸性高锰酸钾溶液氧化,使高锰酸钾溶液褪色,不能确定含有乙烯,应使用溴水,若溴水褪色则证明反应中有乙烯产生,故D实验方法不能达到实验目的;
答案选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知反应![]() 为吸热反应,下列对该反应的说法正确的是( )
为吸热反应,下列对该反应的说法正确的是( )
A.X的能量一定低于M的能量,Y的能量一定低于![]() 的能量
的能量
B.因为该反应为吸热反应,故需要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量
D.反应物X和Y的总能量大于生成物M和N的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1mol·L-1NaHCO3溶液:Na+、Ba2+、NO3-、OH-
B.0.1mol·L-1NaAlO2溶液:K+、OH-、Cl-、NO3-
C.![]() =1.0×1012的溶液:Fe2+、Mg2+、NO3-、I-
=1.0×1012的溶液:Fe2+、Mg2+、NO3-、I-
D.0.1mol·L-1FeCl3溶液:K+、Cu2+、SCN-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.淀粉水解液酸化后加入碘水就能判断淀粉是否水解完全
B.植物秸秆、牛油彻底水解的产物均为纯净物
C.鸡蛋清中加入饱和碳酸钠溶液,生成的沉淀加水不再溶解
D.葡萄糖与果糖、淀粉与纤维素均互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用补钙片的有效成分是CaCO3,某化学探究小组欲测定某补钙片中碳酸钙的含量。查阅资料得知:
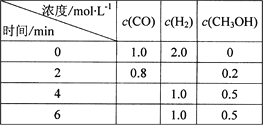
一种常用的分析试剂 EDTA二钠盐(用Na2H2Y2H2O表示)可用于测定Ca2+,其反应为:
Ca2++H2Y2-=CaY2-+2H+,以铬黑T为指示剂,滴定终点溶液由红色变为蓝色。于是该实验小组做了如下实验:
步骤一:配制待测溶液。取适量补钙片研碎后,准确称取0.400g配成250mL溶液。
步骤二:滴定。用移液管取待测液25.00mL于锥形瓶中,加入适量NaOH溶液,摇
匀,再加入铬黑T指示剂3滴,用0.0100molL1EDTA二钠盐溶液滴定至终点。三次重复滴定平均消耗EDTA二钠盐溶液22.50mL。
请回答下列问题:
(1)步骤一中补钙剂要用2mol/L的盐酸溶解,反应的离子方程式为__________________,配制待测溶液所必需的仪器除研钵、药匙、分析天平、称量瓶、烧杯、玻璃棒外,还有_______、________,操作的先后顺序为:e→____→____→d→f→____→____→____(填下列操作的序号)。
A.盐酸溶解 b.称量 c.定容摇匀 d.加蒸馏水稀释 e.研磨
f.用NaOH溶液调节溶液pH至7 g.转移溶液 h.洗涤并转移
(2)实验测得补钙片中CaCO3的含量为_______。
(3)下列操作会导致测定结果偏高的是_______(填下列选项的字母序号)。
A.未将洗涤烧杯内壁的溶液转入容量瓶
B.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
C.定容时俯视刻度线
D.滴定管下端尖嘴中有气泡存在,滴定后气泡消失
E.滴定管用蒸馏水洗净后未用标准液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Z具有广谱抗菌活性,可利用X和Y反应获得。下列有关说法正确的是( )
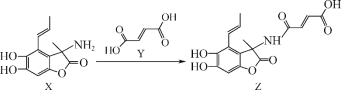
A.有机物X的分子式为C12H13O4N
B.有机物Y可以和乙醇发生缩聚反应
C.有机物Y中所有原子可能在同一平面上
D.1mol有机物Z与足量NaOH溶液反应最多消耗4mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天门冬氨酸锌是一种补锌剂,可以用天门冬氨酸(![]() )和锌的化合物为原料制备。
)和锌的化合物为原料制备。
(1)天门冬氨酸分子中氮原子的轨道杂化类型为___;天门冬氨酸所含σ键和π键的数目之比为___;其所含四种元素电负性由大到小的顺序为___。
(2)Zn(NO3)2中所含NO![]() 的空间构型为___(用文字描述)。
的空间构型为___(用文字描述)。
(3)工业ZnCl2中常混有杂质TiCl4,TiCl4室温下为无色液体,熔沸点低,易升华,可溶于甲苯和氯代烃等非极性溶剂中,它的晶体类型是___。Ti的价电子排布式为___。
(4)ZnO的晶胞结构如图所示,Zn2+的配位数为___。
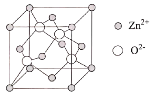
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题。
(1)工业尾气中含有大量的氮氧化物,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
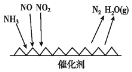
①由图可知SCR技术中的氧化剂为____。
②用Fe作催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1:1时,写出该反应的化学方程式:_______。
(2)ClO2气体是一种常用的消毒剂,现在被广泛用于饮用水消毒。自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg/L。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样用微量的氢氧化钠溶液调至中性,然后加入一定量的碘化钾,并加入淀粉溶液,溶液变蓝![]()
Ⅱ.加入一定量的Na2S2O3溶液(已知:2S2O32-+I2=S4O62-+2I-)
Ⅲ.加硫酸调节水样pH至1.3。
已知:ClO2在中性条件下还原产物为ClO2-,在酸性条件下还原产物为Cl-。请回答下列问题:
①确定操作Ⅱ完全反应的现象为________。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式为______。
③若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol/L的Na2S2O3溶液10 mL,则水样中ClO2的浓度是____mg/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com