
(14分)工业上用辉铜矿(主要成分Cu2S,含Fe3O4、SiO2杂质)为原料,生产硫酸铜晶体的工艺流程如下:

已知:①固体B为氧化物组成的混合物 ②[Cu(NH3)4]2+(aq)  Cu2+(aq) + 4NH3(aq)
Cu2+(aq) + 4NH3(aq)
(1)气体X是 ,高温下在过量空气中煅烧辉铜矿时,Cu2S发生反应的方程式为: 。
(2)固体B酸溶时加入稀硫酸和H2O2,目的是 ,不用浓硫酸的原因是 。
(3)鉴别溶液D中Fe3+完全除尽的方法是 。滤液G的主要溶质是 (填化学式)。
(4)由溶液E获得硫酸铜晶体的实验操作I的方法是蒸发浓缩、降温结晶、 、烘干。
(5)用“间接碘量法”测定所制备的CuSO4·5H2O(不含能与I-反应的氧化性杂质)的纯度。取a g试样配成100 mL溶液,取25.00 mL该溶液,滴加KI溶液后有白色碘化物沉淀生成,滴加KI溶液至沉淀不再产生为止,然后用硫代硫酸钠标准溶液滴定生成的I2,发生反应的化学方程式为I2+2Na2S2O3===2NaI+Na2S4O6,消耗c mol·L-1 Na2S2O3溶液的体积为V mL。
①写出CuSO4与KI反应的离子方程式_________________________。
②计算试样中CuSO4·5H2O的纯度____________________(用a、c、V表示)。
(1)SO2 Cu2S+2O2 2CuO+SO2 或2Cu2S+3O2
2CuO+SO2 或2Cu2S+3O2 2Cu2O+2SO2
2Cu2O+2SO2
(2)溶解CuO、Fe3O4,并将Fe2+氧化为Fe3+ 浓硫酸与Fe2+反应会生成对环境有污染的SO2
(3)取少量D溶液于试管中,滴入KSCN溶液,若溶液未出现血红色,则证明Fe3+完全除尽 (NH4)2SO4
(4)过滤洗涤
(5)① 2Cu2++4I-==2CuI↓+I2 ②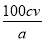 %
%
【解析】
试题分析:(1)高温下在过量空气中煅烧辉铜矿,Cu2S会和氧气反应生成SO2,所以气体X是SO2,Cu2S发生反应的方程式为Cu2S+2O2 2CuO+SO2 或2Cu2S+3O2
2CuO+SO2 或2Cu2S+3O2 2Cu2O+2SO2
2Cu2O+2SO2
(2)稀硫酸与Fe3O4 反应生成硫酸亚铁和硫酸铁,和氧化铜反应生成硫酸铜,和SiO2 不反应,所以固体B中加入稀硫酸和H2O2,目的是溶解CuO、Fe3O4,并将Fe2+氧化为Fe3+,该反应不能采用浓硫酸溶液,是因为浓硫酸与Fe2+反应会生成对环境有污染的SO2。
(3)检验Fe3+是否存在可以用KSCN溶液,所以鉴别溶液D中Fe3+完全除尽的方法是取少量D溶液于试管中,滴入KSCN溶液,若溶液未出现血红色,则证明Fe3+完全除尽,前面相继除去了硅元素,铁元素,滤渣是CuO,所以滤液G的主要溶质是(NH4)2SO4。
(4)由溶液获得晶体的基本操作是蒸发浓缩、降温结晶、过滤洗涤、烘干等。
(5)用硫酸铜与碘化钾反应,然后用Na2S2O3滴定反应生成的I2,说明Cu2+能将I-氧化成碘单质,滴加KI溶液后有白色碘化物沉淀生成,说明有CuI生成,所以CuSO4与KI反应的离子方程式为2Cu2++4I-==2CuI↓+I2。
根据化学反应2Cu2++4I-==2CuI↓+I2,I2+2Na2S2O3===2NaI+Na2S4O6 得到关系式为 Cu2+—Na2S2O3,所以CuSO4·5H2O的物质的量等于Na2S2O3 的物质的量=c·V×10-3mol,所以试样中CuSO4·5H2O的纯度= (c·V×10-3×250)÷0.25a×100%=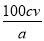 %。
%。
考点:考查工业生产硫酸铜晶体的工艺流程,铜及其化合物的性质,氧化还原反应滴定等知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:填空题
(15分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
a | b | ||||||||||||||||
c | d | ||||||||||||||||
e | f | g | h | i | |||||||||||||
j | |||||||||||||||||
(1)j是钴元素,试写出该元素的基态原子电子排布式 。
(2)c、d原子半径大小c d,第一电离能大小关系是c d,
电负性大小关系是d c。(以上填“>”或 “<”或“=”)
(3)已知NH3·H2O的电离方程式为NH3·H2O NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____________(填序号 a 或 b ,见下图) 。
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____________(填序号 a 或 b ,见下图) 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:填空题
铜族元素包括Cu、Ag、Au,其单质均为面心立方晶体。
(1)基态Au原子有 个未成对电子,Cu2+的电子排布式为 ,向Cu2+溶液中加入足量的氨水后,再加入无水乙醇,可析出一种配合物,其中N原子的杂化轨道类型为______________,该配合物的颜色为 。
(2)Cu2O是一种共价型化合物,其立方晶胞内:氧原子分别位于立方体的顶点和体心,则该晶胞中有个铜原子,其中氧原子的配位数为 。
(3)钇钡铜氧超导体的理想晶胞如图所示,其化学式为: ,该晶体中Y为+3,Ba为+2,铜为+2、+3,则铜元素中+2价铜的百分含量为 ;Y的价电子排布式为4d15s2,则Y在周期表的位置: ,

(4)已知Ag的晶胞参数a=0.408 nm,列式表示Ag单质的密度_________g·cm-3(不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三下学期第一次月考理科综合化学试卷(解析版) 题型:选择题
分子式为C9H18O2的有机物Q,在稀硫酸中经加热转化为一种与乙酸乙酯互为同分异构体的酸性物质A,同时生成另一种物质B,若不考虑立体异构,则Q的结构最多有
A.16种 B.8种 C.4种 D.2种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省兰州市高三下学期诊断考试理综化学试卷(解析版) 题型:推断题
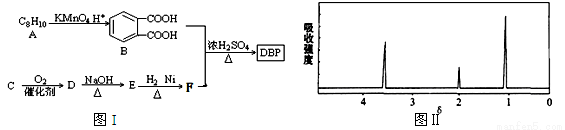
[化学―选修5:有机化学基础](15分)塑化剂主要用作塑料的增塑剂,也可作为农药载体、驱虫剂和化妆品等的原料。添加塑化剂(DBP)可改善白酒等饮料的口感,但超过规定的限量会对人体产生伤害。其合成线路图如图I所示:
已知以下信息:
①
② (—R1、R2表示氢原子或烃基)
(—R1、R2表示氢原子或烃基)
③C为含两个碳原子的烃的含氧衍生物,其核磁共振氢谱图如图II所示
(1)C的结构简式为 ,E中所含官能团的名称是 。
(2)写出下列有关反应的化学方程式:
①E和H2以物质的量比1︰1反应生成F: ;
②B和F以物质的量比1︰2合成DBP: ;反应类型为 。
(3)同时符合下列条件的B的同分异构体有 种,写出其中任意两种同分异构体的结构简式 。
①不能和NaHCO3溶液反应 ②能发生银镜反应
③遇FeC13溶液显紫色 ④核磁共振氢谱显示苯环上只有一种氢原子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省兰州市高三下学期诊断考试理综化学试卷(解析版) 题型:选择题
下列有关有机化合物的结构和性质的叙述,正确的是
A.苯的硝化、丙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应
B.C8H10含苯环的烃同分异构体有3种
C.乙烯、苯、乙烷分子中的所有原子都在同一平面上
D.莽草酸( )能使溴的四氯化碳溶液褪色
)能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高三质量检查理综化学试卷(解析版) 题型:填空题
(15分)铝及其化合物用途广泛
(1)铝元素的离子结构示意图为
(2)下列实验能说明Al的金属性(原子失电子能力)小于Na的是 (填序号)。
a.分别将Na和Al同时放人冷水中
b.测定等物质的量的Na和A1与酸反应生成H2的体积
c.向Al(OH)3悬浊液中加人足量NaOH溶液
d.用pH计测量NaCl溶液与AlC13溶液的pH
(3)工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,每生产1吨Al,阳极大约会损失0.6吨的石墨,则石墨被氧化为 (填化学式)。
(4)碳在高温下与Al2O3反应生成Al4C3固体和CO2该反应每转移1 mol电子,吸热a kJ,该反应的热化学方程式为____
(5)室温下,往0.2 mol·L-1 Al2 ( SO4)3溶液中逐滴加人1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化的曲线如图所示
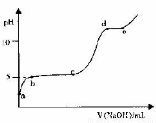
①a点溶液呈酸性的原因是(用离子方程式表示)_______
②c→d时,A1元素的主要存在形式是 (填化学式)
③根据图中数据计算,A1(OH)3的KSP ≈ 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三3月教学质量检查理综化学试卷(解析版) 题型:选择题
四种短周期元素在周期表中的位置如右图,其中X元素的原子最外层电子数等于其电子层数。
下列说法不正确的是
Z | W | ||
X | Y |
A.X位于元索周期表中第3 周期、ⅢA族
B.原子半径:X > Z > W
C.最简单气态氢化物的热稳定性:W > Y
D.Y的最高价氧化物可以和W的最简单氢化物反应
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市等三校高二上学期期末化学试卷(解析版) 题型:选择题
下列溶液中有关物质的浓度关系正确的是
A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4) > c[(NH4)2SO4]> c(NH4Cl)
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.1.0 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
D.某二元弱酸酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com