
【题目】![]() 铜镁合金完全溶解于
铜镁合金完全溶解于![]() 、密度为
、密度为![]() 、质量分数为
、质量分数为![]() 的浓硝酸中,得到
的浓硝酸中,得到![]() 气体
气体![]() 标准状况
标准状况![]() ,向反应后的溶液中加入适量的
,向反应后的溶液中加入适量的![]() 溶液,恰使溶液中的金属离子全部沉淀,下列说法不正确的是
溶液,恰使溶液中的金属离子全部沉淀,下列说法不正确的是![]()
![]()
A.该浓硝酸中HNO3的物质的量浓度是14 mol/L
B.加入NaOH溶液的体积是160 mL
C.起氧化性的硝酸的物质的量为0.16 mol
D.得到的金属氢氧化物的沉淀为6.24 g
【答案】B
【解析】
c(HNO3)=![]() =
=![]() =14 mol/L,n(NO2)=
=14 mol/L,n(NO2)=![]() =0.16 mol据此计算。
=0.16 mol据此计算。
A.根据上面分析可知c(HNO3)=14 mol/L ,故不选A;
B.加入适量的1.0mol/LNaOH溶液,恰使溶液中的金属离子全部沉淀,此时溶液中溶质为NaNO3,由N元素守恒可知n(NaNO3)+n(NO2)=n(HNO3),由钠离子守恒n(NaOH)=n(NaNO3),则n(NaOH)=1.4 mol-0.16 mol=1.24 mol,则NaOH溶液的体积是1 240 mL,故选B;
C.起氧化性的硝酸反应生成NO2气体,HNO3~NO2,根据计算,起氧化性的硝酸的物质的量为0.16 mol,故不选C;
D.由电荷守恒可知,氢氧化物中氢氧根的物质的量等于转移电子物质的量,氢氧化物质量=合金质量+氢氧根离子质量=3.52g+0.16mol×17g/mol=6.24g,故不选D;
答案:B。


科目:高中化学 来源: 题型:
【题目】如图展示了近代化学发展的几个重要里程碑。下列说法正确的是( )
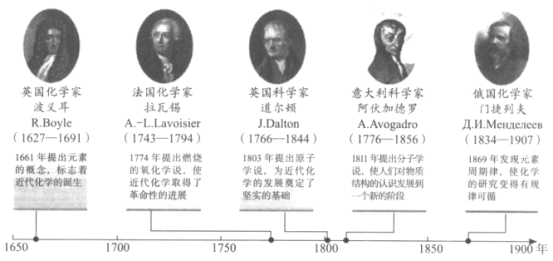
A.1661年波义耳提出了元素的概念并发现了同位素
B.1774年拉瓦锡提出燃烧的氧化学说并揭示了氧化还原反应的本质
C.1803年道尔顿提出原子学说并揭示了原子构成的奥秘
D.1869年门捷列夫发现了元素周期律并制成了第一张元素周期表
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )

A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示。请回答:

(1)醋酸的电离平衡常数表达式为:__________________________。
(2)a、b、c三点c(H+)由大到小的顺序是________________________________________。
(3)a、b、c三点中醋酸的电离程度最大的点是________点。
(4)若使c点溶液中的c(CH3COO-)提高,可采取的措施是________(填标号)。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水 E.加固体CH3COONa F.加锌粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 镁铝合金加入到
镁铝合金加入到![]() 稀硝酸中,恰好完全反应后,收集到还原产物NO气体
稀硝酸中,恰好完全反应后,收集到还原产物NO气体![]() 标准状况,假设反应中还原产物只有
标准状况,假设反应中还原产物只有![]() ,向所得溶液中加入
,向所得溶液中加入![]() 溶液
溶液![]() ,沉淀部分溶解,下列有关叙述错误的是
,沉淀部分溶解,下列有关叙述错误的是
A.合金中Al的质量分数约为![]()
B.原稀硝酸的浓度为![]()
C.反应最终产生沉淀![]()
D.向产生沉淀后的混合液中滴加![]() 稀硝酸,产生的沉淀完全溶解
稀硝酸,产生的沉淀完全溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量的镁铝合金与![]() 稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入
稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入![]() NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。下列说法 不正确的是
NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。下列说法 不正确的是
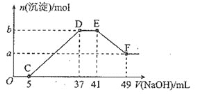
A.![]()
B.OC段反应的离子方程式为![]()
C.D点对应溶液中的溶质为![]() 和
和![]()
D.原![]() 溶液中溶质的物质的量浓度为
溶液中溶质的物质的量浓度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物种类繁多,无处不在:
(1)白蚁信息素![]() 用系统命名法命名___;
用系统命名法命名___;
(2)人造羊毛的结构为![]() ,则合成人造羊毛的单体是___;
,则合成人造羊毛的单体是___;
(3)丙醛是一种精细化工原料,写出丙醛与银氨溶液反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PI3)引用作新敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成。回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) △H1。
CH3NH2(g)+H2O(g) △H1。
①NH3电子式为_______。
②已知该反应中相关化学键的键能数据如下:

则该反应的△H1=_______kJ·mol-1
(2)上述反应中所需的甲醇可以利用甲烷为原料在催化剂作用下直接氧化来合成。煤炭中加氢气可发生反应:C(s)+2H2(g)![]() CH4(g) △H2。在密闭容器中投入碳和H2,控制条件使其发生该反应,测得碳的平衡转化率随压强及温度的变化关系如图中曲线所示。
CH4(g) △H2。在密闭容器中投入碳和H2,控制条件使其发生该反应,测得碳的平衡转化率随压强及温度的变化关系如图中曲线所示。

①该反应的△H2_______0(填“>” 、“<”或“=”),判断理由是_______。
②在4MPa、1100K时,图中X点v正(H2)____ v逆(H2)(填“>”、“<”或“=”)。该条件下,将1molC和2molH2通入密闭容器中进行反应,平衡时测得的转化率为80%,CH4的体积分数为______。若维持容器体积不变,向其中再加入0.5mo1C和1mo1H2,再次达到平衡后,平衡常数K_____(填“增大”、“减小”或“不变”)。
③某化学兴趣小组提供下列四个条件进行上述反应,比较分析后,你选择的反应条件是______(填字母序号)。
A.5MPa 800K B.6MPa 1000K C.10MPa 1000K D.10MPa 1100K
(3)已知常温下PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,Pb(NO3)2溶液与KI溶液混合可形成PbI2沉淀。现将浓度为2×10-3mol·L-1的Pb(NO3)2溶液与一定浓度的KI溶液等体积混合,则生成沉淀所需KI溶液的最小浓度为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com