
【题目】已知阴离子交换膜只允许阴离子通过。某化学课外活动小组采用如下方案对印刷电路废液(溶质主要是FeCl2、CuCl2和 FeCl3)进行再生,先向废液中加入过量铁粉,充分反应后过滤,再将滤液转入下图所示的装置中进行电解。下列说法中不正确的是
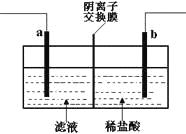
A.电解时,电极a应与外电源的正极相连
B.电解时,电极b周围产生无色无味的气体
C.电解时,电极a发生的反应是:2Cl--2e-=Cl2↑
D.电解时,可以用氯化钠溶液替代稀盐酸
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以纯铜屑为原料制取的流程如下:
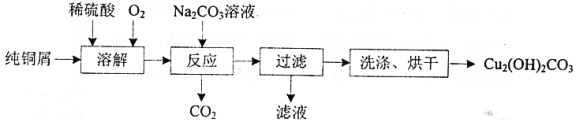
(1)“溶解”步骤反应的离子方程式为_______.温度宜控制在50℃左右,若高于50℃,溶液中O2溶解量减少、Cu的转化率降低,若低于50℃ ,_____
(2)“反应”步骤生成Cu2(OH)2CO3的化学方程式为_________。反应后溶液中铜元素残留量受pH和反应时间的影响如图所示:
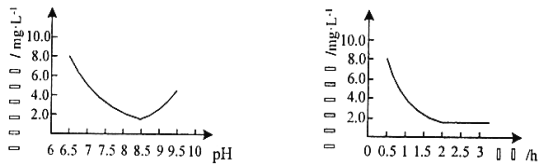
判断反应的最佳条件: pH为___、反应时间为____h。
(3)检验Cu2(OH)2CO3洗涤是否完全的方法是____________________
(4) Cu2(OH)2CO3也可以表示为CuCO3·Cu(OH)2。 查阅文献,上述反应条件下还可能生成少量CuCO3·Cu(OH)2。为测定产品的纯度[产品中Cu2(OH)2CO3的质量分数],取10.97g干燥样品,400℃左右加热,测得固体质量随时间变化关系如图所示。
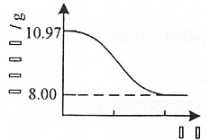
已知: 8.00g固体为黑色纯净物。
有关物质的摩尔质量如表:
物质 | CuCO3·Cu(OH)2 | CuCO3·2Cu(OH)2 | CuO |
摩尔质量/g·mol-1 | 222 | 320 | 80 |
请计算产品的纯度(写出计算过程,结果保留3位有效数字)。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料在日常生活、生产中有着广泛的运用,下列关于金属的说法不正确的是
A.工业上金属Mg、Al都是用电解熔融的氯化物制得的
B.合金的性质与其成分金属的性质不完全相同
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下某体积一定的密闭容器中发生的反应aA(g)+bB(g)![]() xC(g)符合下图甲所示关系(c%表示平衡混合气体中C的百分含量,T表示温度,p表示压强)。则图乙中纵轴y是指
xC(g)符合下图甲所示关系(c%表示平衡混合气体中C的百分含量,T表示温度,p表示压强)。则图乙中纵轴y是指

A. 平衡混合气的密度
B. 平衡混合气中B的百分含量
C. 平衡混合气的总物质的量
D. 平衡混合气的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的少D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中进行反应:3SiCl4(g)+2N2(g)+6H2(g) ![]() Si3N4(s)+12HCl(g)能表示上述反应达到化学平衡状态的是
Si3N4(s)+12HCl(g)能表示上述反应达到化学平衡状态的是
A.v逆(N2)=3v正(H2)
B.v正(HCl)=4v正(SiCl4)
C.混合气体密度保持不变
D.c(N2) :c(H2) :c(HCl)=1:3:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组利用Na2SO3和浓硫酸制备SO2并进行相关实验探究。实验方案如图。
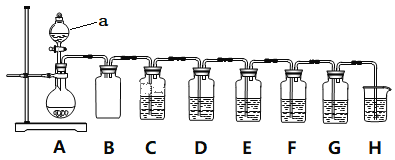
已知:各装置中的试剂,C(品红溶液)、D(酸性KMnO4溶液)、E(H2S溶液)、F(淀粉I2水溶液)、G(H2O2和BaCl2混合液)
(1)仪器组装完后首先要进行的操作是____________________。
(2)仪器a的名称是________________;装置B的作用_____________________。
(3)装置A中发生反应的化学方程式____________________。
(4)装置C和G中的现象:C___________________;G___________________;
(5)设计装置D和E的目的是验证SO2的___________性和___________性。
(6)装置H中的试剂是______________;其作用是_____________________。
(7)F中反应的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1mol化学键所需的能量(kJ):N≡N键为942、N—N键为154、N—H键为391、H—O键为463。有关化学反应的能量变化如图所示。下列说法正确的是( )
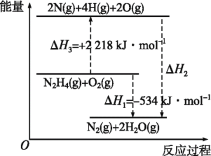
A.ΔH2=ΔH1+ΔH3
B.断裂1molO2(g)中的共价键需要吸收500kJ的能量
C.ΔH2>ΔH1
D.N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH=-534kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.分子式满足C6H12的有机物所有碳原子可能位于同一平面上
B.1mol乙烷在光照条件下最多能与3molCl2发生取代反应
C.甲烷、苯和油脂均不能使酸性KMnO4溶液褪色
D.分子式为C4H10O且能与金属钠反应的有机物有3种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com