
【题目】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Ni、Fe、Al2O3、CaO、炭及有机物等)制取CoC2O4的工艺流程如下:
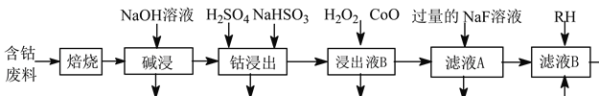
己知:①草酸钴晶体难溶于水
②RH为有机物,可用RH、有机溶剂萃取出溶液中的Ni2+
③几种金属阳离子的氢氧化物沉淀时的PH如表所示:
Fe3+ | Co2+ | |
开始沉淀时 | 1.9 | 7.1 |
沉淀完全时 | 3.7 | 9.1 |
(1)“焙烧”的目的_______。
(2)“碱浸”过程中Al2O3发生反应的化学方程式为_______。
(3) 经硫酸酸化后,“钴浸出”过程中Co3+转化为Co2+的离子方程式为_______。
(4)“浸出液B”中加入CoO并调节pH值至3.7~7.1的目的为_______。
(5) 加入NaF溶液可将钙离子转化为沉淀并过滤除去,若所得滤液中c(F-)=1.0×10-2mol·L1,则滤液中c(Ca2+)为_______mol·L1[已知Ksp(CaF2)=1.05×10-10]。
(6) 萃取后水层中含有大量的Co2+,将水层与酸性KMnO4溶液充分混合生成Co3+、Mn2+,理论上完全反应消耗的n(Co2+)∶n(MnO4-)=_______。
【答案】除去炭和有机物 Al2O3 + 2NaOH =2NaAlO2 + H2O 2Co3+ +![]() +H2O = 2Co2+ +
+H2O = 2Co2+ +![]() +3H+ 使Fe3+完全转化为Fe(OH)3沉淀 1.05×10-6 5:1
+3H+ 使Fe3+完全转化为Fe(OH)3沉淀 1.05×10-6 5:1
【解析】
含钴废料通过“焙烧”除去炭及有机物;“碱浸”加NaOH溶液将Al2O3变为NaAlO2除去;“钴浸出”得到含Co2+、Fe2+、Ni2+、Ca2+、SO42-的浸出液B;含Co2+、Fe2+、Ni2+、Ca2+、SO42-的浸出液B中加H2O2将Fe2+氧化成Fe3+,加入CoO调节pH值至3.7~7.1、过滤除去Fe3+,得含Co2+、Ni2+、Ca2+、SO42-的滤液A;含Co2+、Ni2+、Ca2+、SO42-的滤液A中加入NaF溶液将Ca2+变为CaF2沉淀,再经过滤除去CaF2得含Co2+、Ni2+、SO42-、Na+的滤液B;含Co2+、Ni2+、SO42-、Na+的滤液B加RH萃取Ni2+,除去RH层,得含Co2+、Na+、SO42-的溶液,据此解答。
(1)“焙烧”的目的是除去炭和有机物,故答案为:除去炭和有机物;
(2)“碱浸”过程中Al2O3和NaOH反应生成NaAlO2和H2O,发生反应的化学方程式为Al2O3 + 2NaOH =2NaAlO2+ H2O,故答案为:Al2O3 + 2NaOH =2NaAlO2+ H2O;
(3)HSO3-具有还原性,将Co3+还原为Co2+,自身被氧化成SO42-,反应的离子方程式为:2Co3++![]() +H2O = 2Co2++
+H2O = 2Co2++![]() +3H+,故答案为:2Co3++
+3H+,故答案为:2Co3++![]() +H2O = 2Co2++
+H2O = 2Co2++![]() +3H+;
+3H+;
(4)“浸出液B”中加入CoO并调节pH值至3.7~7.1的目的是使Fe3+完全转化为Fe(OH)3沉淀,故答案为:使Fe3+完全转化为Fe(OH)3沉淀;
(5)由Ksp(CaF2)=c(Ca2+)×c2(F-)得:c(Ca2+)=![]() = 1.05×10-6mol·L1,故答案为:1.05×10-6;
= 1.05×10-6mol·L1,故答案为:1.05×10-6;
(6)1molCo2+变为Co3+,失1mol电子,1molMnO4-变为1molMn2+,得(7-2)mol=5mol电子,根据得失电子守恒得:n(Co2+)∶n(MnO4-)=5:1,故答案为:5:1。


 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】对相同物质的量的乙烯和丙烯,有下列叙述:①碳原子数之比为 2:3②氢原子数之比为 2:3③含碳的质量分数相同④分子个数之比为 1:1.其中正确的是 ( )
A.①④B.①②④C.①②③D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
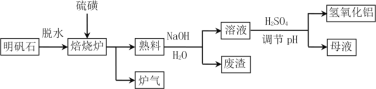
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S ![]() 2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
(2)将标况下1.12L炉气通入100mL 0.5mol·L-1 NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为___________________________________。
(3)熟料溶解时反应的离子方程式为_________________________。
(4)母液中溶质主要成分的化学式为____________、_____________,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是 ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车发动机工作时会产生包括CO、NOx等多种污染气体,如何处理这些气体,对保护大气环境意义重大,回答下列问题:
(1)已知:2NO2(g) ![]() 2NO(g)+O2(g) ΔH1=+115.2 kJ·mol-1;
2NO(g)+O2(g) ΔH1=+115.2 kJ·mol-1;
2O3(g) ![]() 3O2(g) ΔH2=-286.6 kJ·mol-1。
3O2(g) ΔH2=-286.6 kJ·mol-1。
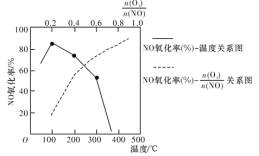
写出臭氧与NO作用产生NO2和O2的热化学方程式:___________。恒容密闭体系中NO氧化率随![]() 值的变化以及随温度的变化曲线如图所示。NO氧化率随
值的变化以及随温度的变化曲线如图所示。NO氧化率随![]() 值增大而增大的主要原因是________________________。
值增大而增大的主要原因是________________________。
(2)实验测得反应2NO(g)+O2(g) ![]() 2NO2(g) △H<0的即时反应速率满足以下关系式:v正=k正·c2(NO)·c(O2);v逆=k逆·c2(NO2),k正、k逆为速率常数,受温度影响
2NO2(g) △H<0的即时反应速率满足以下关系式:v正=k正·c2(NO)·c(O2);v逆=k逆·c2(NO2),k正、k逆为速率常数,受温度影响
①温度为T1时,在1L的恒容密闭容器中,投入0.6 molNO和0.3 molO2达到平衡时O2为0.2 mol;温度为T2时,该反应存在k正=k逆,则T1_______ T2 (填“大于”、“小于”或“等于”)。
②研究发现该反应按如下步骤进行:
第一步:NO+NO![]() N2O2 快速平衡 第二步:N2O2 +O2
N2O2 快速平衡 第二步:N2O2 +O2![]() 2NO2 慢反应
2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v1正=k1正×c2(NO);v1逆=k1逆×c(N2O2)
下列叙述正确的是______
A.同一温度下,平衡时第一步反应的![]() 越大反应正向程度越大
越大反应正向程度越大
B.第二步反应速率低,因而转化率也低
C.第二步的活化能比第一步的活化能低
D.整个反应的速率由第二步反应速率决定
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:2NO2(g)+4CO(g) ![]() 4CO2(g)+N2(g) △H<0
4CO2(g)+N2(g) △H<0
某温度下,向10L密闭容器中分别充入0.1molNO2和0.2 molCO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
回答下列问题:
①在此温度下,反应的平衡常数Kp=_________kPa-1(Kp为以分压表示的平衡常数,计算结果精确到小数点后2位);若保持温度不变,再将CO、CO2气体浓度分别增加一倍,则平衡_____(填“右移”或“左移”或“不移动”);
②若将温度降低,再次平衡后,与原平衡相比体系压强(p总)如何变化?_______(填“增大”、“减小”或“不变”),原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用苯乙酮间接电氧化法合成苯甲酸,原理如图所示:
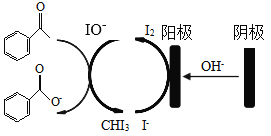
实验步骤如下:
步骤I:电合成:在电解池中加入KI、20mL蒸馏水和20mL的1,4-二氧六环,搅拌至完全溶解,再加入20mL苯乙酮,连接电化学装置,恒定电压下电解7h;
步骤II:清洗分离:反应停止后,将反应液转移至烧瓶,蒸馏除去反应溶剂;用蒸馏水和二氯甲烷洗涤烧瓶,将洗涤液转移至分液漏斗;用二氯甲烷萃取除去质,分离出水相和有机相;
步骤III:制得产品:用浓盐酸酸化水相至pH为1~2,接着加入饱和NaHSO3溶液,振荡、抽滤、干燥,称量得到产品7.8g;
有关物质的数据如下表所示:
物质 | 分子式 | 溶解性 | 沸点(℃) | 密度(g/cm3) | 相对分子质量 |
苯乙酮 | C8H8O | 难溶于水 | 202.3 | 1.03 | 120 |
苯甲酸 | C7H6O2 | 微溶于水 | 249 | 1.27 | 122 |
二氯甲烷 | CH2Cl2 | 不溶于水 | 40 | 1.33 | 85 |
回答下列问题:
(1)步骤I中,阴极的电极反应式为________________________ ,苯乙酮被氧化的离子方程式为_____________________
(2)步骤II蒸馏过程中,需要使用到的玻璃仪器有____________,(填标号)除此之外还需要____________________
(3)步骤II分液过程中,应充分振荡,静置分层后________(填标号)
A.直接将有机相从分液漏斗的上口倒出
B.直接将有机相从分液漏斗的下口放出
C.先将有机相从分液漏斗的下口放出,再将水相从下口放出
D.先将有机相从分液漏斗的下口放出,再将水相从上口倒出
(4)步骤III中,加入浓盐酸的目的是____________________
(5)步骤III中,加入饱和NaHSO3溶液,水相中的颜色明显变浅,说明过量的I2被还原为I-,其离子方程式为_______________________
(6)本实验的产率是______________(保留小数后一位有效数字)
(7)得到的粗苯甲酸可用____________法进行提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量。量筒的规格为1 000 mL,供选择的电极材料有纯铜片和纯锌片。
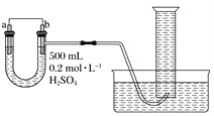
请回答下列问题:
(1)b电极材料为___,其电极反应式为____。
(2)当量筒中收集到672 mL(标准状况下)气体时,通过导线的电子的物质的量为___mol,此时a电极质量____(填“增加”或“减少”)___g。
(3)如果将a、b两电极的电极材料对调,U形管中将出现的现象是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
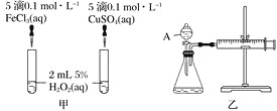
(1)若利用图甲装置,可通过观察__________现象,从而定性比较得出结论。
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 ________。写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___________。
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为________,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
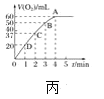
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:________。H2O2初始物质的量浓度为_______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是

A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C. 阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D. 除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活、生产和社会可持续发展密切相关,下列有关说法或操作不正确的是( )
①为增强消毒液(有效成分NaClO)的消毒能力,可以滴加几滴浓盐酸
②新冠病毒可以采用高温或酒精来杀死,均利用的是蛋白质的变性
③常见的化学键有离子键、共价键、氢键
④石油的蒸馏、分馏、精馏是物理变化,而煤的干馏是化学变化
⑤硅酸钠俗称水玻璃
⑥苯在工业上,既可以以煤为原料制备,也可以以石油为原料制备
A.①②⑥B.①③⑤C.③⑤⑥D.①④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com