
【题目】如图所示为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。

请回答下列问题:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为________。
(2)AB段曲线所表示的反应的离子方程式为_________________________。
(3)向B处生成的溶液中通入二氧化碳,可观察到的现象是_______________________。
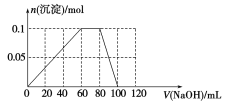
(4)向含有0.1 mol NH4Al(SO4)2的溶液中逐滴加入5 mol·L-1 NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。

【答案】(1)13;(2)Al(OH)3+OH-===AlO2-+2H2O;(3)生成白色沉淀;
(4)
【解析】
试题分析:(1)A点沉淀达到最大,OA段发生离子反应方程式为:Al3++3OH-=Al(OH)3↓,两者物质的量之比为1:3;(2)氢氧化铝属于两性氢氧化物,因此AB段发生离子反应方程式为:Al(OH)3+OH-=AlO2-+2H2O;(3)B中溶质为NaAlO2,因为碳酸的酸性强于偏铝酸,因此有2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,因此有白色沉淀产生;(4)Al3+得OH-的能力强于NH4+,因此先发生Al3++OH-=Al(OH)3↓,生成最大沉淀时,消耗NaOH的体积为60mL,然后发生NH4++OH-=NH3·H2O,此时沉淀的质量不变,此阶段消耗的NaOH的体积为20mL,最后发生的是Al(OH)3+OH-=AlO2-+2H2O,此时消耗的NaOH的体积为20mL,因此图像是:


科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1;②H2(g)+![]() O2(g)===H2O(l)
O2(g)===H2O(l)
ΔH=-285.8 kJ·mol-1;
③C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ·mol-1; ④C(s)+O2(g)===CO2(g)
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1; ④C(s)+O2(g)===CO2(g)
ΔH=-393.5 kJ·mol-1。
回答下列各问题:
(1)H2的燃烧热为___________,C的燃烧热为_______________。
(2)燃烧10 g H2生成液态水,放出的热量为__________________。
(3)盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可通过间接的方法测定,则由已知条件得CO的燃烧热为____________,其燃烧热的热化学方程式为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Na2CO3固体中混有少量NaHCO3固体,除去杂质的方法是________________,化学方程式是___________________________________。
(2)NaHCO3固体中混有少量Na2CO3固体,除杂方法是________________,化学方程式是________________________________________________________。
(3)NaOH固体中混有少量Na2CO3固体,除杂方法是________________,反应的离子方程式是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密闭容器中进行,10 s时,水蒸气的物质的量增加了0.60 mol。则下列说法不正确的是( )
4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密闭容器中进行,10 s时,水蒸气的物质的量增加了0.60 mol。则下列说法不正确的是( )
A. 10 s内,NH3的平均反应速率为0.008 mol·L-1·s-1
B. 该反应达到平衡时6v正(O2)=5v逆(H2O)
C. 10 s内,反应放出的热量为0.1a kJ
D. 10 s时,H2O的反应速率为0.012 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各题:
(1)实验室保存FeCl2溶液时,常向其中加入少量铁粉原因是__________________(用离子方程式表示)。
某同学为检验某未知溶液中是否为FeCl2溶液,采取如下实验方案加以验证:稍取未知试液于试管中![]() 溶液
溶液![]() 溶液呈血红色(证明含有FeCl2),你认为此方案________(填“合理”或“不合理”),若不合理,如何改进_______________________________________(若合理,该问不填)。
溶液呈血红色(证明含有FeCl2),你认为此方案________(填“合理”或“不合理”),若不合理,如何改进_______________________________________(若合理,该问不填)。
(2)A、B、C、D、E分别是铁或铁的化合物。其中D是一种红褐色沉淀。其相互反应关系如图所示:

根据如图所示变化,按要求回答下列问题:
①写出A、E的化学式:A________,E________;
②写出其中几步反应的化学方程式:
C→B:________________________________________________________________________;
B→D:________________________________________________________________________;
E→A:________________________________________________________________________。
③C中加入NaOH溶液,看到的现象是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用下图所示仪器装置设计一个包括电解饱和食盐水并测定电解时产生的氢气的体积和检验氯气的氧化性的实验装置。
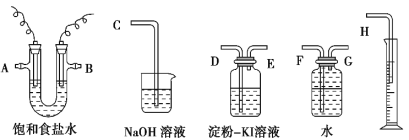
(1)所选仪器 连接时,各接口的顺序是(填各接口的代号字母):A 接 , 接 ,B 接 , 接 。_____________
(2)实 验 时 , 装 置 中 的 石 墨 电 极 接 电 源 的 _____极 , 所 发 生 的 电 极 反 应 式 为_____;铁电极接电源的_____极,所发生的电极反应式为_____; 此电解总反应方程式为_________。
(3)实验测得产生的氢气体积(已折算成标准状况)为 5.60 mL,电解后溶液的体积恰好为50.0 mL,则溶液中 OH-的浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程为: 。为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时你觉得还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4 溶液液面下,再挤出NaOH溶液,这样操作的理由是 。
(4)检验Fe3+存在的最佳试剂是 ,现象是 。
(5)写出Fe与H20在一定条件下反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2C2O4是二元弱酸,室温下向某浓度的草酸溶液中逐滴加入KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-的组成百分率与pH的关系如图所示,下列说法正确的是
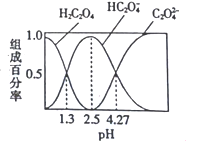
A. pH=4.27的溶液中:c(K+)+c(H+)=c(OH-)+3c(C2O42-)
B. 反应HC2O4-+H2O![]() H2C2O4+OH-的平衡常数为10-4.27
H2C2O4+OH-的平衡常数为10-4.27
C. 向溶液中加入KOH溶液将pH由1.3调至4.27的过程中水的电离程度先增大后减小
D. pH=2.5的溶液中:c(H+)+2c(H2C2O4)=c(OH-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对中学课本中可生成氢气的反应进行了研究,总结出两个可以生成H2的反应:①Zn+盐酸;②Na+水。为点燃经验纯后上述两个反应生成的H2,他们设计了图示装置。请回答下列问题:

(1)写出Na与H2O反应的化学方程式:__。
(2)实验小组在点燃用上述装置制得的H2时,实验①获得成功,实验②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是__。
(3)实验小组查阅资料知钠、煤油、水的密度分别为0.97 g·cm-3、0.8 g·cm-3、1.00 g·cm-3,并据此对实验进行改进,在改进后的实验中H2的生成速率减慢,原因是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com