
【题目】下列说法不正确的是( )
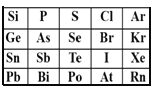
A. 稳定性:HBr<HI<Hat
B. 酸性:H3PO4<H2SO4<HClO4
C. 原子半径:Sn>As>S
D. 表中,元素Pb的金属性最强
【答案】A
【解析】
A.同主族元素从上到下元素的非金属性逐渐降低,则非金属性:Br>I>At,元素的非金属性越强,对应的氢化物越稳定,则稳定性:HAt <HI<HBr,故A错误;
B.同周期元素从左到右元素的非金属性之间增强,则非金属性:Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性:H3PO4<H2SO4<HClO4,故B正确;
C.同周期元素从左到右原子半径逐渐减小,则原子半径:Si>S;Ge>As。原子核外电子层数越多,半径越大,Sn> Ge > Si 。则原子半径:Sn>As>S,故C正确;
D.同主族元素从上到下元素的金属性逐渐增强,同周期元素从左到右元素的金属性逐渐减弱,故表中元素Pb的金属性最强,故D正确;
答案选A。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某同学按下图所示的装置进行实验。![]() 、
、![]() 为两种常见金属,它们的硫酸盐可溶于水,当
为两种常见金属,它们的硫酸盐可溶于水,当![]() 闭合时,
闭合时,![]() 从右向左通过交换膜移向
从右向左通过交换膜移向![]() 极。下列分析不正确的是
极。下列分析不正确的是

A. 溶液中![]() 增大
增大
B. ![]() 极的电极反应:
极的电极反应:![]()
C. ![]() 电极上有
电极上有![]() 产生,发生氧化反应
产生,发生氧化反应
D. 反应初期,![]() 电极周围出现白色胶状沉淀
电极周围出现白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表所示化学反应与数据关系:
化学反应 | 平衡常数 | 温度 | |
973 K | 1 173 K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
请回答:
(1)反应①是________(填“吸热”或“放热”)反应。
(2)写出反应③的平衡常数K3的表达式_______________________。
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有________(填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO浓度
(5)若反应③的逆反应速率与时间的关系如图所示:
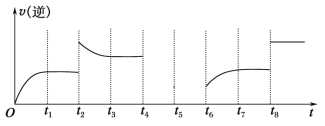
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时________;t8时________。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰是重要的合金材料和催化剂,在工农业生产和科技领域有广泛的用途。请回答下列问题:
(1)溶液中的Mn2+可被酸性![]() 溶液氧化为MnO4-,该方法可用于检验Mn2+。
溶液氧化为MnO4-,该方法可用于检验Mn2+。
①检验时的实验现象为_________。
②该反应的离子方程式为___________。
③ ![]() 可看成两分子硫酸偶合所得,若硫酸的结构式为
可看成两分子硫酸偶合所得,若硫酸的结构式为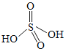 ,则
,则![]() 的结构式为_________。
的结构式为_________。
(2)实验室用含锰废料(主要成分![]() ,含有少量
,含有少量![]() )制备Mn的流程如下:
)制备Mn的流程如下:
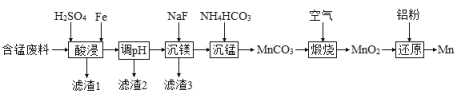
已知:Ⅰ.难溶物的溶度积常数如下表所示:
难溶物 |
|
|
|
|
溶度积常数( | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
Ⅱ.溶液中离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全。
①“酸浸”时,![]() 将Fe氧化为Fe3+。该反应的离子方程式为________;该过程中时间和液固比对锰浸出率的影响分别如图1、图2所示:
将Fe氧化为Fe3+。该反应的离子方程式为________;该过程中时间和液固比对锰浸出率的影响分别如图1、图2所示:
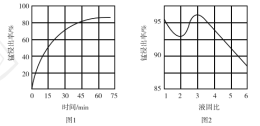
则适宜的浸出时间和液固比分别为___________、___________。
②若“酸浸”后所得滤液中c(Mn2+)=0.18 mol·L-1,则调pH”的范围为___________。
③“煅烧”反应中氧化剂和还原剂的物质的量之比为_______。“还原”时所发生的反应在化学上又叫做_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷和镍是重要的材料和化工领域用途广泛。请回答下列问题:
(1)基态As原子中,价电子的电子云轮廓图形状为___。与砷同周期的主族元素的基态原子中,电负性最大的为____(填元素符号)。
(2)![]() 可用于碘的微量分析。
可用于碘的微量分析。
①Na+的焰色反应呈黄色,很多金属元素能产生焰色反应的微观原因为_______。
②其中阴离子的VSEPR模型为_____,与其互为等电子体的分子为_____(只写一种分子式即可)。
(3)M(![]() )可用于合成Ni2+的配体,M中C原子的杂化形式为______,σ键和π键的数目之比为_____。
)可用于合成Ni2+的配体,M中C原子的杂化形式为______,σ键和π键的数目之比为_____。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点都比金属Ca高,原因为______。区分晶体Ni和非晶体Ni的最可靠的科学方法为_______。
(5)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为![]() ,该晶体的密度ρ=____g·cm-3。
,该晶体的密度ρ=____g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水凝胶材料要求具有较高的含水率,以提高其透氧性能,在生物医学上有广泛应用。由N-乙烯基吡咯烷酮(NVP)和甲基丙烯酸![]() -羟乙酯(HEMA)合成水凝胶材料高聚物A的路线如图:
-羟乙酯(HEMA)合成水凝胶材料高聚物A的路线如图:
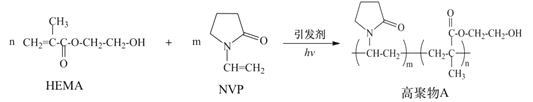
下列说法正确的是
A. NVP具有顺反异构
B. 高聚物A因含有-OH而具有良好的亲水性
C. HEMA和NVP通过缩聚反应生成高聚物A
D. 制备过程中引发剂浓度对含水率影响关系如图,聚合过程中引发剂的浓度越高越好

查看答案和解析>>
科目:高中化学 来源: 题型:
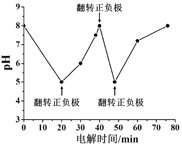
【题目】生活污水中的氮和磷主要以铵盐和磷酸盐形式存在,可用电解法从溶液中去除。电解装置如图:以铁作阴极、石墨作阳极,可进行除氮;翻转电源正负极,以铁作阳极、石墨作阴极,可进行除磷。
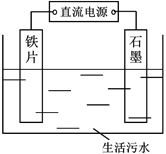
I.电解除氮
(1)在碱性溶液中,NH3能直接在电极放电,转化为N2,相应的电极反应式为:_______。
(2)有Cl-存在时,除氮原理如图1所示,主要依靠有效氯(HClO、ClO-)将NH4+ 或NH3氧化为N2。在不同pH条件下进行电解时,氮的去除率和水中有效氯浓度如图2:
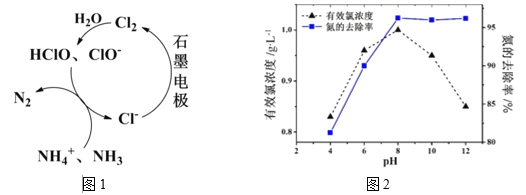
①当pH<8时,主要发生HClO氧化NH4+ 的反应,其离子方程式为:____________。
②结合平衡移动原理解释,当pH<8时,氮的去除率随pH的降低而下降的原因是:_____。
③当pH>8时,ClO-发生歧化导致有效氯浓度下降,而氮的去除率却并未明显下降,可能的原因是(答出一点即可):______。
II.电解除磷
(3)除磷的原理是利用Fe2+ 将PO43- 转化为Fe3(PO4)2沉淀。
①用化学用语表示产生Fe2+的主要过程:_______________。
②如图为某含Cl- 污水在氮磷联合脱除过程中溶液pH的变化。推测在20-40 min时脱除的元素是________。
(4)测定污水磷含量的方法如下:取100mL污水,调节至合适pH后用AgNO3溶液使磷全部转化为Ag3PO4沉淀。将沉淀过滤并洗涤后,用硝酸溶解,再使用NH4SCN溶液滴定产生的Ag+,发生反应Ag++SCN-=AgSCN↓,共消耗c mol/LNH4SCN溶液V mL。则此污水中磷的含量为___mg/L(以磷元素计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新化学键形成的过程。化学键的键能是两个原子间形成1 mol化学键时释放的能量或断开1 mol化学键所吸收的能量。
现提供以下化学键的键能:(kJ·mol1)P—P:198 P—O:360 O==O:498 P==O:585。
则P4(白磷)+5O2![]() P4O10是___反应(填“放热”或“吸热”),能量变化为___kJ。(提示:白磷是正四面体形的分子,如图
P4O10是___反应(填“放热”或“吸热”),能量变化为___kJ。(提示:白磷是正四面体形的分子,如图 ,当与氧形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键结合一个氧原子)
,当与氧形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键结合一个氧原子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物X、Y和高聚物Z,可以用烃A为主要原料,采用以下路线:

已知:I.反应①、反应②均为加成反应。
II.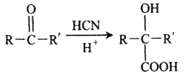
请回答下列问题:
(1)A的结构简式为_____________。
(2)Z中的官能团名称为____________,反应③的条件为___________.
(3)关于药物Y(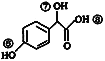 )的说法正确的是____________。
)的说法正确的是____________。
A.1mol药物Y与足量的钠反应可以生成33.6 L氢气
B.药物Y的分子式为C8H8O4,能使酸性高锰酸钾溶液褪色
C.药物Y中⑥、⑦、⑧三处-OH的活泼性由强到弱的顺序是⑧>⑥>⑦
D.1mol药物Y与H2、浓溴水中的Br2反应,最多消耗分别为4 mol和2 mol
(4)写出反应E→F的化学方程式______________________________________。F→X的化学方程式______________________________________________。
(5)写出符合下列条件的E的一种同分异构体的结构简式_______________。
①遇FeCl3溶液可以发生显色反应,且是苯的二元取代物;
②能发生银镜反应和水解反应;
③核磁共振氢谱有6个峰。
(6)参考上述流程以CH3CHO和CH3OH为起始原料,其它无机试剂任选设计合成Z的线路___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com