
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去)。
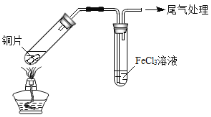
A B
(1)实验前,应先检查装置的 ;实验中产生的尾气应通入 溶液。
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、胶头滴管、玻璃棒、 。
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A。 |
写出装置A中产生SO2的化学方程式: 。
(4)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因(用化学用语解释): 。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式: 。
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验。
步骤② | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
步骤③ | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
⑹综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III. 。
【答案】
(1)气密性 NaOH (2)100mL容量瓶
(3)Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(4)H2O+SO2![]() H2SO3;H2SO3
H2SO3;H2SO3![]() H++HSO3-;
H++HSO3-;
Fe3++HSO3-![]() Fe(HSO3)2+
Fe(HSO3)2+
Fe3++H2O+Fe(HSO3)2+=2Fe2++SO42-+3H+
(5)加热或提高FeCl3溶液的酸性会缩短浅绿色出现的时间
【解析】
试题分析:(1)有气体参加的化学实验,实验前,应先检查装置的气密性;SO2是酸性氧化物,与碱反应,所以实验中产生的尾气应通入NaOH溶液 。
(2)配制溶液需要的玻璃仪器有烧杯、量筒、胶头滴管、玻璃棒和100mL容量瓶。
(3)装置A中是铜和浓硫酸在加热的条件下发生反应生成硫酸铜、SO2和水,所以产生SO2的化学方程式为Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑+2H2O。
CuSO4 + SO2↑+2H2O。
(4)SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因为H2O + SO2![]() H2SO3 、H2SO3
H2SO3 、H2SO3 ![]() H++HSO3-、Fe3+ + HSO3-
H++HSO3-、Fe3+ + HSO3-![]() Fe(HSO3)2+;Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+,则溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式为Fe3+ + H2O + Fe(HSO3)2+ = 2Fe2+ + SO42- + 3H+。
Fe(HSO3)2+;Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+,则溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式为Fe3+ + H2O + Fe(HSO3)2+ = 2Fe2+ + SO42- + 3H+。
(5)通过实验得出结论为加热或提高FeCl3溶液的酸性会缩短浅绿色出现的时间。


科目:高中化学 来源: 题型:
【题目】化学与生活.生产密切相关,下列有关叙述正确的是
A.氢氧化铝.小苏打.纯碱均可用作胃酸中和剂
B.古代的陶瓷.水泥.石英玻璃等,都是硅酸盐产品
C.将草木灰(含K2CO3)与NH4Cl混合使用会降低肥效
D.石油的分馏.煤的干馏等物理变化在生产中有着重要的地位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A.苯只能发生取代反应,乙烯只能发生加成反应
B.甘氨酸和丙氨酸混合物脱水成肽,最多可生成4种二肽
C.C4H9OH有4种同分异构体
D.C3H6和C4H8一定是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一。工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),常见处理法有:
(1)可用氨催化吸收法处理NOx,反应原理如下:4xNH3+6NOx![]() (2x+3)N2+6xH2O
(2x+3)N2+6xH2O
某化学兴趣小组模拟该处理过程的实验装置如下:
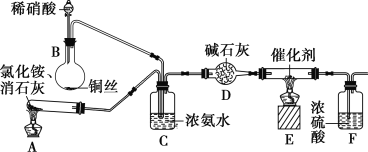
①装置A中发生反应的化学方程式为________________________________。
②装置D中碱石灰的作用是____________________。
(2)用Na2CO3溶液吸收法处理NOx。已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3===2NaNO2+CO2 (Ⅰ)
2NO2+Na2CO3===NaNO2+NaNO3+CO2 (Ⅱ)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是________(填字母)。
A.1.9 B.1.7 C.1.5 D.1.3
②用足量的Na2CO3溶液完全吸收NOx,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则NOx中的x值为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
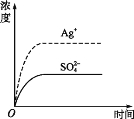
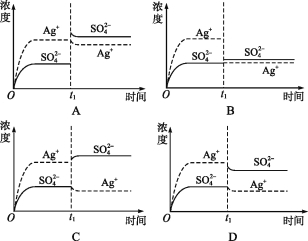
【题目】已知Ag2SO4的Ksp 为2.0×10-5,将适量Ag2SO4固体溶于水中配成100 mL饱和溶液,该过程中Ag+和SO42-浓度随时间变化关系如图[饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1]。若t1时刻在上述体系中加入100 mL 0.020 mol·L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是( )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在N2F2分子中,所有原子均符合8电子稳定结构,则该分子中两个氮原子之间的键型构成是( )
A. 仅有一个σ键 B. 仅有一个π键
C. 一个σ键,一个π键 D. 一个σ键,两个π键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com