
【题目】汽车尾气排放的CO、NOx等气体是大气污染的主要来源,NOx也是雾霾天气的主要成因之一。
i.在汽车排气管加装催化转化器,可有效降低污染物的浓度,发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H<0。为了模拟催化转化器的工作原理,在t℃时,将2molNO与1mol CO充入1L反应容器中,反应过程中NO(g)、CO(g)、N2(g)的物质的量变化如图所示,
N2(g)+2CO2(g)△H<0。为了模拟催化转化器的工作原理,在t℃时,将2molNO与1mol CO充入1L反应容器中,反应过程中NO(g)、CO(g)、N2(g)的物质的量变化如图所示,

(1)①则反应进行到20min时,CO2的平均反应速率为________________.
②28min~36min内NO、CO、N2的物质的量发生了变化(NO、CO图像未画出),引起该变化的条件可能是______.
a.加入催化剂 b.通入0.2mol N2
c.缩小容器体积 d.增加CO2的物质的量
③当36min达到平衡后,若保持体系温度为t℃,再向容器中充入CO、CO2气体,使两者物质的量浓度均加倍,平衡将__________移动(填“向左”、“向右”或“不”)
(2)若均取2molNO和1molCO的混合气体分别放入3种不同的容器中进行该反应,A容器保持恒温恒压,B容器保持恒温恒容,C容器保持恒容绝热,且初始时3个容器的容积和温度均相同,下列说法正确的是______.
a.3个容器中NO的平衡转化率的大小顺序为 aA>aB>aC.
b.当A容器内气体的平均摩尔质量不变时,说明该反应处于化学平衡状态
c.A、B两个容器达到平衡所用的时间:tA>tB
d.当C容器内平衡常数不变时,说明该反应处于化学平衡状态
ii. 某温度下,NO2(g)+SO2(g)SO3(g)+NO(g)的平衡常数K=![]() ,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如表所示,
,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如表所示,
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/molL﹣1 | 0.10 | 0.20 | 0.20 |
c(SO2)/molL﹣1 | 0.10 | 0.10 | 0.20 |
(3)①10min后,甲中达到平衡,则甲中NO2的转化率α(NO2)=_______________.
②达到平衡后,设甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为_____________.
(4)利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如图所示。

电极b的电极反应式为__________________;常温下,若用该电池电解0.6L饱和食盐水,消耗标准状况下448mL NH3时, 发现两极产生相同体积的气体,则此时溶液的PH=____(假设电解过程溶液体积不变)。
【答案】 0.02mol·L-1·min-1 c 不 abd 60% b>a=c 2NO2+8e-+4H2O=N2+8OH- 13
【解析】(1)①反应进行到20min时生成氮气是0.2mol,根据方程式可知同时生成二氧化碳是0.4mol,浓度是0.4mol/L,则CO2的平均反应速率为0.4mol/L÷20min=0.02mol·L-1·min-1;②a、加入催化剂,平衡不移动,a错误;b、通入0.2mol氮气,平衡向逆反应方向移动,最终平衡后氮气的物质的量小于0.4mol,b错误;c、缩小容器体积,平衡向正反应方向移动,达平衡时,浓度增大,c正确;d、增加CO2的物质的量,平衡向逆反应方向移动,氮气的平衡浓度降低,d错误,答案选c;③当36min达到平衡后,若保持体系温度为t℃,再向容器中充入CO、CO2气体,使两者物质的量浓度均加倍,根据反应的平衡常数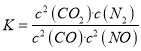 可知平衡常数不变,所以平衡将不移动;(2)a、对于A容器,该反应是一个气体体积缩小的反应,随着反应进行气体体积减小,但要保持恒压,必须压缩体积,相当与增大压强,NO的转化率增大,B容器为恒容,随着反应的进行,气体体积缩小,NO转化率相对A要小,C容器恒温绝热,该反应为放热反应,温度升高,速率加快,平衡逆向移动,相对B容器NO的转化率减小,a正确;b、气体质量不变,物质的量在发生改变,平均摩尔质量是变量,能判断平衡,b正确;c、A容器压强比B大,故反应速率快,达到平衡所需的时间A比B短,C错误;d、平衡常数只是温度的函数,温度不变,平衡常数不变,d正确;答案选abd;
可知平衡常数不变,所以平衡将不移动;(2)a、对于A容器,该反应是一个气体体积缩小的反应,随着反应进行气体体积减小,但要保持恒压,必须压缩体积,相当与增大压强,NO的转化率增大,B容器为恒容,随着反应的进行,气体体积缩小,NO转化率相对A要小,C容器恒温绝热,该反应为放热反应,温度升高,速率加快,平衡逆向移动,相对B容器NO的转化率减小,a正确;b、气体质量不变,物质的量在发生改变,平均摩尔质量是变量,能判断平衡,b正确;c、A容器压强比B大,故反应速率快,达到平衡所需的时间A比B短,C错误;d、平衡常数只是温度的函数,温度不变,平衡常数不变,d正确;答案选abd;
(3)① NO2(g)+SO2(g)SO3(g)+NO(g)
起始浓度(mol/L) 0.10 0.10 0 0
转化浓度(mol/L) x x x x
平衡浓度(mol/L) 0.10-x 0.10-x x x
则根据平衡常数可知![]()
解得x=0.06,则甲中NO2的转化率α(NO2)=0.06/0.10×100%=60%;②乙相当于是在甲的基础上增大二氧化氮浓度,平衡向正反应方向进行,二氧化硫的转化率增大;由于反应前后体积不变,甲和丙是等效平衡,所以甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为b>a=c;
(4)电极b通入二氧化氮,发生得到电子的氧化反应,电极反应式为2NO2+8e-+4H2O=N2+8OH-;氨气的物质的量是0.448L÷22.4L/mol=0.02mol,转移0.06mol电子,根据电子守恒可知生成氢气和氯气均是0.03mol,同时生成氢氧化钠是0.06mol,浓度是0.06mol÷0.6L=0.1mol/L,所以pH=13。


科目:高中化学 来源: 题型:
【题目】用铝粉和四氧化三铁粉末配成铝热剂,分成两等份:一份在高温下恰好反应,再与足量稀硫酸反应, 生成氢气aL;另一份直接放入足量氢氧化钠溶液中充分反应,在同条件下生成氢气bL,则a∶b为( )
A. 1∶1 B. 3∶4 C. 4∶3 D. 8∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有下列物质:①Fe ②NH4Cl溶液③Na2O ④Cu(OH)2 ⑤熔融的MgCl2 ⑥H2SO4 ⑦CO2 ⑧C2H5OH(酒精)(用序号作答)。其中属于电解质的有_____________,属于非电解质的有________________。
Ⅱ、某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种,请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子所发生的离子方程式为______________________________________。
(3)取(2)中的滤液,加入过量的NaOH出现白色沉淀,说明原溶液中肯定有的该离子所发生的离子方程式为___________________________。
(4)通过以上实验确定原溶液中一定含有的阳离子是_________,不能确定的阳离子是_________。
(5)原溶液可能大量存在的阴离子是下列的________。
A.Cl- B.NO![]() C.CO
C.CO![]() D.OH-
D.OH-
Ⅲ.现有M、N两种气态化合物,其摩尔质量之比为2:1,试回答下列问题:
(1)同温同压下,M、N气体的密度之比为____________。
(2)相同温度下,在两个相同体积的密闭容器中分别充入M、N,若两个容器中气体的密度相等,则两个容器中的压强之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强氧化剂XO(OH)2+ 被Na2SO3还原。如果还原1.2×10-3 mol XO(OH)2+,需用30 mL 0.1mol·L-1的Na2SO3溶液,那么X元素被还原后的物质可能是( )
A. XO B. X2O3 C. X2O D. X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍氢电池具有性能好、寿命长等优点,其反应原理是NiO(OH)+ MH==NiO+M + H2O,MH可理解为储氢合金M中吸收结合氢原子,下列说法不正确的是

A. MH电极是负极
B. OH-向MH极移动
C. 正极电极反应式:NiO(OH)+e-=NiO+OH-
D. 电子从MH电极流向NiO(OH)电极,经KOH溶液流回MH极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 甲烷分子的比例模型为![]() ,其二氯取代物有2种结构
,其二氯取代物有2种结构
B. 苯和乙烯都能使溴水褪色,其褪色原理相同
C. 相同质量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的物质的量相同
D. 在一定条件下,苯与氯气生成氯苯的反应类型是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下.体积和pH均相同的氨水和氢氧化钠溶液,加水稀释过程中pH变化如图所示,下列说法正确的是

A. a曲线代表氢氧化钠溶液
B. 分別加水稀释100倍后溶液中的c(H+),氢氧化钠溶液大于氨水
C. 分别加入相同浓度醋酸溶液中和至溶液呈中性,消耗醋酸两者相等
D. 分别与体积、浓度均相同的FeCl3溶液反应,生成沉淀质量一定是氨水多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把a、b、c、d四块金属片浸在稀硫酸中,用导线两两连接可以组成原电池,若a、b相连时a为负极;a、c相连时c极上产生大量气泡;b、d相连时b为正极;c、d相连时,电流由d到c。则这四种金属的活动性顺序由大到小为( )
A. a>c>d>b B. a>b>c>d C. c>a>b>d D. b>d>c>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com