
【题目】高铁酸钾(K2FeO4)是一新型高效无毒的多功能水处理剂。资料:K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4
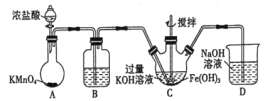
①写出A中发生反应的化学方程式______。
②除杂装置B中的试剂为____。
③C为制备K2FeO4装置,KOH溶液过量的原因是____。
④D为尾气处理装置,发生反应的离子方程式为____。
(2)探究K2FeO4的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl而产生Cl2设计以下方案:
方案Ⅰ | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生 |
①由方案Ⅰ中溶液变红可知a中含有____。该离子的产生__(填“能”或“不能”)判断一定是由K2FeO4被Cl还原而形成的。
②方案Ⅱ用KOH溶液洗涤的目的是____,方案Ⅱ得出氧化性:Cl2 ___FeO42(填“![]() ”或“
”或“![]() ”)。
”)。
【答案】2KMnO4+16HCl(浓)=2MnCl2+5Cl2↑+2KCl+8H2O 饱和氯化钠溶液 K2FeO4微溶于KOH溶液,在碱性溶液中较稳定(或有利于生成K2FeO4) Cl2+2OH=Cl+ClO+H2O Fe3+ 不能 排除ClO的干扰,防止干扰后续实验,同时减少K2FeO4晶体损失 ﹤
【解析】
(1)制备K2FeO4,由实验装置可知,A中浓盐酸与高锰酸钾反应生成氯气,B中饱和食盐水可除去挥发的HCl,C中KOH、氢氧化铁、氯气反应生成K2FeO4,D中NaOH吸收尾气;
(2)①由方案I中溶液变红,可知含铁离子,可能为K2FeO4与酸反应生成;
②方案Ⅱ用KOH溶液洗涤,可除去干扰离子,且氧化剂的氧化性大于氧化产物的氧化性。
(1)①装置A为制取浓盐酸和高锰酸钾反应制取氯气,反应方程式为:2KMnO4 +16 HCl(浓)= 2MnCl2+ 5Cl2↑+ 2KCl + 8H2O;
②除杂装置B中的试剂为饱和氯化钠溶液;
③C为制备K2FeO4装置,KOH溶液过量的原因是K2FeO4微溶于KOH溶液,在碱性溶液中较稳定;
④D为尾气处理装置,发生反应的离子方程式为Cl2+2OH=Cl+ClO+H2O;
(2)①由方案I中溶液变红可知a中含有Fe3+,该离子的产生不能判断一定是由K2FeO4被Cl还原而形成的,可能为K2FeO4与酸反应生成;
②方案Ⅱ用KOH溶液洗涤的目的是排除ClO的干扰,防止干扰后续实验,同时减少K2FeO4晶体损失;氧化剂的氧化性大于氧化产物的氧化性,方案Ⅱ中K2FeO4将Cl氧化生成Cl2,则氧化性:Cl2﹤FeO42。


 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,它们的原子最外层电子数总和等于Z的原子序数,由这四种元素组成一种化合物M具有如下性质下列推断正确的是( )
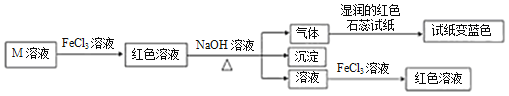
A.原子半径:Z>Y>X>W
B.最高价氧化物对应的水化物酸性:Y>X
C.简单阴离子的还原性: Z>W
D.W、Y、Z组成的化合物只含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为酷似奥林匹克旗中五环的一种有机物被称为奥林匹克烃,下列说法中正确的是( )
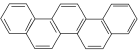
A. 该有机物属于芳香族化合物,是苯的同系物
B. 该有机物是只含非极性键的非极性分子
C. 该有机物的一氯代物只有七种
D. 该有机物完全燃烧生成H2O的物质的量小于CO2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室为探究铁与浓硫酸的反应,并验证SO2的性质,设计如图所示装置进行实验。
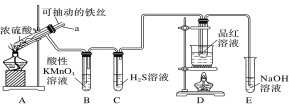
请回答下列问题:
(1)实验时将导管a插入试管中,可使装置B中的溶液不发生倒吸。其原因是______。
(2)装置B中酸性KMnO4溶液逐渐褪色,则装置B中发生反应的离子方程式是_____;装置C中出现的现象是________。
(3)装置D的作用是__________;实验结束时需从导管a通入大量空气,其目的是_______。
(4)若装置A反应后的溶液中金属阳离子只含有Fe3+,则装置A中发生反应的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《新修本草》中关于“青矾”的描述:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中说:“青矾厂气熏人,衣服当之易烂,栽木不茂”,下列相关叙述不正确的是
A. 赤色固体可能是Fe2O3
B. 青矾宜密闭保存,防止氧化变质
C. 青矾燃烧过程中发生了电子转移
D. “青矾厂气”可能是CO和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行的反应C(s)+H2O(g)![]() CO(g)+H2(g),能使反应速率加快的措施有( )
CO(g)+H2(g),能使反应速率加快的措施有( )
①增加炭的量②升高温度③将炭粉碎④恒容通入水蒸气⑤通过减小容器体积增大压强⑥恒容通入N2
A.②③④⑤B.②③④⑤⑥C.①②③④⑤D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究原电池产生电流的过程,设计了如图所示实验:
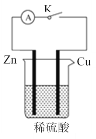
(1)下列叙述中正确的是__。
A.打开开关K时铜片作负极,关闭开关K时铜片作正极
B.打开开关K,锌片和铜片上均有气泡产生
C.关闭开关K后,溶液中的H+浓度减小
D.关闭开关K产生气泡的速率比打开开关K时慢
(2)打开开关K后,装置中发生反应的离子方程式为___。
(3)关闭开关K后,则该装置为__(填“原电池”或“电解池”),铜极上的电极反应式为__。若反应过程中有0.3mol的电子发生转移,则产生的气体在标准状况下的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是( )
A.氢气的燃烧热为285.5 kJmol-1,则水电解的热化学方程式为:2H2O(l)![]() 2H2(g)+O2(g)
2H2(g)+O2(g) ![]() H=+285.8kJmol-1
H=+285.8kJmol-1
B.1mol甲烷完全燃烧生成CO2 (g)和H2O(l)时放出890kJ热量,它的热化学方程式为 1/2CH4(g)+O2(g) ![]() 1/2CO2(g)+H2O(l)
1/2CO2(g)+H2O(l) ![]() H=-445kJmol-1
H=-445kJmol-1
C.已知2C(s)+O2(g) ![]() 2CO(g)
2CO(g) ![]() H=-221kJmol-1,则C的燃烧热为110.5 kJmol-1
H=-221kJmol-1,则C的燃烧热为110.5 kJmol-1
D.HF与NaOH溶液反应:H+(aq)+OH-(aq) = H2O(l) ![]() H=-57.3kJmol-1
H=-57.3kJmol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com