
【题目】卤块的主要成分是MgCl2,此外还含有Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
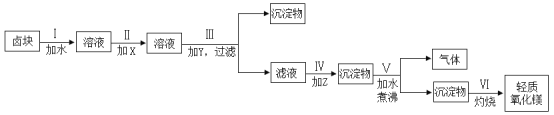
已知1:生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
已知2:几种难溶电解质的溶解度(20℃)
物质 | 溶解度/g |
Fe(OH)2 | 5.2×10-5 |
Fe(OH)3 | 3×10-9 |
MgCO3 | 3.9×10-2 |
Mg(OH)2 | 9×10-4 |
(已知:Fe2+氢氧化物呈絮状,不易从溶液中除去)
请回答:
(1)步骤Ⅱ中加入的试剂X为漂液(含25.2%NaClO)。
①用玻璃棒蘸取漂液滴在pH试纸上,pH试纸先变蓝,后褪色。说明漂液具有的性质是________。
②用化学用语表示NaClO溶液使pH试纸变蓝的原因_________。
③步骤Ⅱ中漂液的主要作用是__________。
④若用H2O2代替漂液,发生反应的离子方程式为_________。
(2)步骤Ⅲ中加入的试剂Y为NaOH,应将溶液的pH调节为______,目的是_______。
(3)步骤Ⅳ中加入的试剂Z为Na2CO3,发生反应的离子方程式为_______。
(4)结合化学用语,应用化学平衡移动原理解释步骤Ⅴ中反应发生的原因_______。
【答案】碱性、强氧化性(漂白性)ClO-+H2O![]() HClO+OH-将Fe2+氧化为Fe3+2Fe2++H2O2+2H+=2Fe3++2H2O9.8使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去Mg2++CO32-=MgCO3↓沉淀物MgCO3存在溶解平衡,MgCO3(s)
HClO+OH-将Fe2+氧化为Fe3+2Fe2++H2O2+2H+=2Fe3++2H2O9.8使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去Mg2++CO32-=MgCO3↓沉淀物MgCO3存在溶解平衡,MgCO3(s)![]() Mg2+ (aq)+CO32-(aq),CO32-发生水解CO32-+H2O
Mg2+ (aq)+CO32-(aq),CO32-发生水解CO32-+H2O![]() HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O![]() H2CO3+OH-,在煮沸的情况下促进CO32-水解平衡右移。Mg2+与OH-结合生成更难溶的Mg(OH)2沉淀,促进CO32-彻底水解为H2CO3并分解为CO2和H2O。最后使MgCO3转化为Mg(OH)2。或:MgCO3 +H2O
H2CO3+OH-,在煮沸的情况下促进CO32-水解平衡右移。Mg2+与OH-结合生成更难溶的Mg(OH)2沉淀,促进CO32-彻底水解为H2CO3并分解为CO2和H2O。最后使MgCO3转化为Mg(OH)2。或:MgCO3 +H2O![]() Mg(OH)2 +CO2,由于水解生成的Mg(OH)2溶解度更小,煮沸有利于CO32-水解平衡右移,且又有CO2气体生成,使水解趋于完全,MgCO3转化为Mg(OH)2。
Mg(OH)2 +CO2,由于水解生成的Mg(OH)2溶解度更小,煮沸有利于CO32-水解平衡右移,且又有CO2气体生成,使水解趋于完全,MgCO3转化为Mg(OH)2。
【解析】
为除去Fe2+,先将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,然后在滤液中加入纯碱将Mg2+从溶液中以MgCO3沉淀出来,然后加热煮沸可得到Mg(OH)2,灼烧后得到MgO,据此解答。
(1)①漂液(含25.2%NaClO)中NaClO溶液中水解显碱性,pH变蓝色,蓝色褪去是水解生成的次氯酸具有漂白性,用玻璃棒蘸取漂液滴在pH试纸上,pH试纸先变蓝,后褪色,说明漂液具有的性质是碱性、漂白性;
②NaClO溶液使pH试纸变蓝是次氯酸根离子水解生成次氯酸和氢氧根离子,溶液显碱性,反应的离子方程式为ClO-+H2O![]() HClO+OH-;
HClO+OH-;
③步骤Ⅱ中漂液具有强氧化性,氧化亚铁离子为铁离子;
④过氧化氢具有氧化性,酸性溶液中能氧化亚铁离子为铁离子,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)骤Ⅲ中加入的试剂Y为NaOH,应将溶液的pH调节为9.8,使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀以便通过过滤而除去;
(3)步骤Ⅳ中加入的试剂Z为Na2CO3,加入后沉淀镁离子,发生反应的离子方程式为Mg2++CO32-=MgCO3↓;
(4)由于沉淀物MgCO3存在溶解平衡:MgCO3(s)![]() Mg2+ (aq)+CO32-(aq),CO32-发生水解CO32-+H2O
Mg2+ (aq)+CO32-(aq),CO32-发生水解CO32-+H2O![]() HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O![]() H2CO3+OH-,在煮沸的情况下促进CO32-水解平衡右移。Mg2+与OH-结合生成更难溶的Mg(OH)2沉淀,促进CO32-彻底水解为H2CO3并分解为CO2和H2O,所以最后使MgCO3转化为Mg(OH)2。
H2CO3+OH-,在煮沸的情况下促进CO32-水解平衡右移。Mg2+与OH-结合生成更难溶的Mg(OH)2沉淀,促进CO32-彻底水解为H2CO3并分解为CO2和H2O,所以最后使MgCO3转化为Mg(OH)2。


科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于以下物质熔点比较正确的是( )
A.NaCl>金刚石>S>Hg
B.金刚石>NaCl>S>Hg
C.NaCl>金刚石>Hg>S
D.金刚石>NaCl>Hg>S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨作电极,电解盛放在U形管中的饱和NaCl溶液(滴有酚酞溶液),如图。下列叙述正确的是
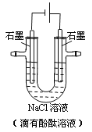
A. 通电后,NaCl发生电离
B. 通电一段时间后,阳极附近溶液先变红
C. 当阳极生成0.1 mol气体时,整个电路中转移了0.1 mol e-
D. 电解饱和食盐水的总反应式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下装置(略去部分夹持装置)模拟利用氨气和次氯酸钠合成肼(N2H4)的过程。下列说法正确的是( )
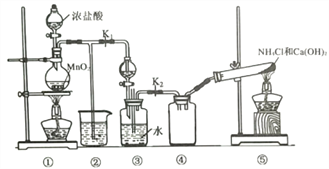
A. 将装置① 中浓盐酸换成H2O2,也可用于制备氧气 B. ②中盛装NaOH溶液,用于吸收多余的Cl2
C. ③分液漏斗中盛装饱和食盐水 D. 当反应结束时,④中可收集一瓶纯净的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(本草纲目》记载了民间酿酒的工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……” 在实验室中模拟上述过程,用到的仪器是
A. 球形冷凝管 B. 蒸发皿 C. 蒸馏烧瓶 D. 分液漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效漂白剂,某小组利用下列装置制备NaClO2,并对其样品进行分析,查阅资料知:NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60℃时析出NaClO2会分解。
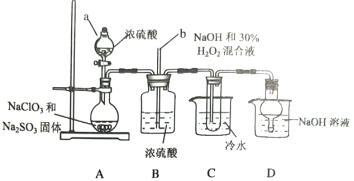
(1)仪器a的名称是__________;长玻璃导管b的作用是__________;装置D的作用是__________。
(2)装置A用于制备ClO2,理论上所加NaClO3和Na2SO3固体的物质的量之比是__________。
装置C中发生的离子方程式是__________。
(3)为提取NaClO2固体,试管中产品需蒸发结晶、过滤、洗涤,洗涤用水的温度范围是__________。
(4)称取Wg的产品配成250mL溶液,取25.00mL溶液,加足量KI和稀H2SO4,以①__________溶液作指示剂,用cmol·L-1Na2S2O3标准液滴定至终点(I2+2S2O32-=2I-+S4O62-),判断滴定终点的现象是②_________;若消耗标准溶液体积的平均值是VmL,则产品中NaClO2的质量分数是③__________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将pH均为2 的HCl与HX 的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是
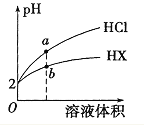
A. a、b两点: c(X-) < c(Cl-) B. 溶液的导电性: a < b
C. 稀释前,c(HX) > 0.01mol/L D. 溶液体积稀释到10倍,HX 溶液的pH < 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷及其化合物在工农业生产中都有重要作用。
(1)基态磷原子价电子排布的轨道表示式为___________。
(2)元素B、N、O的第一电离能由大到小的顺序为___________。
(3)食品添加剂NaNO2中NO2-中心原子的杂化类型是_____,与NO2-互为等电子体的分子的化学式为___________。(写1种)。
(4)N2H4是火箭的燃料,与氧气的相对分子质量相同,它在常温常压下是液态,而氧气是气态,造成这种差异的主要原因是____________。
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化硼和三溴化磷于高温下在氢气中反应合成。
①三溴化磷分子的空间构型是_________,三溴化硼键角是___________。
②磷化硼晶体晶胞如图所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为________,磷原子的配位数为___________,该结构中有一个配位键,提供空轨道的原子是___________。己知晶胞边长apm,阿伏加德罗常数为NA。则磷化硼晶体的密度为___________g/cm3。
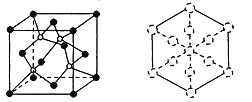
③磷化硼晶胞沿着体对角线方向的投影(图中虚线圆圈表示P原子的投影),用实线圆圈画出B原子的投影位置(注意原子体积的相对大小)。______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com