
【题目】课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g) + 3H2(g) ![]() 2NH3(g) △H<0,△S <0。
2NH3(g) △H<0,△S <0。
(1)下列关于工业合成氨的说法不正确的是_______
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的△H
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是_______
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v正(N2)= v逆(H2)
c.容器内压强保持不变 d.合气体的密度保持不变
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。
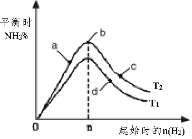
①图象中T2和T1的关系是:T2 __________T1(填“>,<或=”,下同)
②a、b、c、d四点所处的平衡状态中,反应物N2 的转化率最高的是______(填字母)。
(4)恒温下,往一个4L的密闭容器中充入5.2mol H2和2mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此条件下该反应的化学平衡常数K=___________。
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向_______反应方向移动(填“正”或“逆”)。
③N2(g)+3H2(g) ![]() 2NH3(g)△H= -92kJ/mol。在恒温恒容的密闭容器中充入1mol N2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为______mol。
2NH3(g)△H= -92kJ/mol。在恒温恒容的密闭容器中充入1mol N2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为______mol。
(5)已知:N2(g)+3H2(g) ![]() 2NH3(g)△H= -92kJ/mol
2NH3(g)△H= -92kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH= -484kJ/mol
写出氨气催化氧化生成NO和水蒸气的热化学方程式_________。
【答案】ABCD c < c 0.1 逆 3 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH =-906 kJ·mol-1
【解析】
(1)结合△G=△H-T△S和影响平衡的因素分析;
(2)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,以此判断;
(3)①根据温度升高化学平衡向着吸热方向进行;
②根据增加氢气的物质的量化学平衡向着正反应方向移动;
(4)①由表中数据可知,20min达平衡,平衡时NH3的浓度为0.20mol/L,利用三段式计算平衡时各组分的平衡浓度,代入平衡常数表达式k=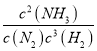 计算;
计算;
②温度不变平衡常数不变,计算此时的浓度,进而计算浓度商Qc,比较浓度商与平衡常数的大小,判断反应进行方向;
③恒温恒容条件下气体的压强与气体的总物质的量成正比;
(5)根据盖斯定律来求反应的焓变。
(1)已知:N2(g) + 3H2(g) ![]() 2NH3(g) △H<0,△S <0;
2NH3(g) △H<0,△S <0;
A.当△G=△H-T△S<0时反应能自发进行,则△H<0时,△G=△H-T△S不一定小于0,即该反应不一定能自发进行,故A错误;
B.当△G=△H-T△S<0时反应能自发进行,则△S<0时,△G=△H-T△S不一定小于0,即该反应不一定能自发进行,故B错误;
C.当升高温度时,N2(g) + 3H2(g) ![]() 2NH3(g) △H<0,平衡逆向移动,反应物的转化率降低,升高温度只是为了加快反应速率,故C错误;
2NH3(g) △H<0,平衡逆向移动,反应物的转化率降低,升高温度只是为了加快反应速率,故C错误;
D.使用催化剂能加快反应速率是因为催化剂降低了反应的活化能,但不影响反应的△H,故D错误;
故答案为ABCD;
(2)a.容器内N2、H2、NH3的浓度之比为1:3:2,不能说明达到判断状态,取决于起始配料比和转化程度,故a错误;
b.当3v正(N2)=v逆(H2)时,说明达到平衡状态,则当v正(N2)= v逆(H2) 不能说明达到平衡状态,故b错误;
c.容器内压强保持不变,说明混合气体的总物质的量保持不变,此时反应达到平衡状态,故c正确;
d.混合气体的质量和体积始终保持不变,则混合气体的密度保持不变无法说明反应达到平衡状态,故d错误;
故答案为c;
(3)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2反应物氮气的量增加,故T1<T2;
②b点代表平衡状态,温度升高平衡逆向移动,则应选择低温平衡正向移动,提高反应物转化率,另外c点又加入了氢气,故平衡向右移动,氮气的转化率增大;
(4)①由表中数据可知,20min达平衡,平衡时NH3的浓度为0.20mol/L,则:
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
开始(mol/L):0.5 1.3 0
变化(mol/L):0.1 0.3 0.2
平衡(mol/L):0.4 1 0.2
故平衡常数k=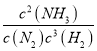 =
=![]() =0.1;
=0.1;
②反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各4mol,则此时各物质的浓度为:H2为1mol/L+![]() =2mol/L,N2为0.4mol/L+
=2mol/L,N2为0.4mol/L+![]() =1.4mol/L,NH3为0.2mol/L+
=1.4mol/L,NH3为0.2mol/L+![]() =1.2mol/L,故浓度商Qc=
=1.2mol/L,故浓度商Qc=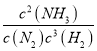 =
=![]() =0.13>0.1,故反应向逆反应移动;
=0.13>0.1,故反应向逆反应移动;
③已知N2(g)+3H2(g) ![]() 2NH3(g)△H= -92kJ/mol,在恒温恒容的密闭容器中充入1mol N2和一定量的H2发生反应,达到平衡后,平衡时混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%,则反应前总物质的量为3.6 mol×
2NH3(g)△H= -92kJ/mol,在恒温恒容的密闭容器中充入1mol N2和一定量的H2发生反应,达到平衡后,平衡时混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%,则反应前总物质的量为3.6 mol×![]() =4mol,故则起始时充入的H2的物质的量为4mol-1mol=3mol;
=4mol,故则起始时充入的H2的物质的量为4mol-1mol=3mol;
(5)已知:①N2(g)+3H2(g) ![]() 2NH3(g)△H= -92kJ/mol,②N2(g)+O2(g)=2NO(g) ΔH= +181kJ/mol,③2H2(g)+O2(g)=2H2O(g) ΔH= -484kJ/mol,由盖斯定律②×2-①×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g),则△H=(+181kJ/mol)×2-(-92kJ/mol)×2+(-484kJ/mol)×3=-906 kJ·mol-1,即氨气催化氧化生成NO和水蒸气的热化学方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH =-906 kJ·mol-1。
2NH3(g)△H= -92kJ/mol,②N2(g)+O2(g)=2NO(g) ΔH= +181kJ/mol,③2H2(g)+O2(g)=2H2O(g) ΔH= -484kJ/mol,由盖斯定律②×2-①×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g),则△H=(+181kJ/mol)×2-(-92kJ/mol)×2+(-484kJ/mol)×3=-906 kJ·mol-1,即氨气催化氧化生成NO和水蒸气的热化学方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH =-906 kJ·mol-1。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组实验测得某硅酸盐所含氧化物的质量分数如下表:
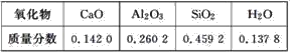
根据表中的数据请写出
(1)该硅酸盐的普通化学式是______________。
(2)用氧化物的形式表示该硅酸盐的组成是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金中含有元素铝、镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验,请回答有关问题:
(1)称取样品a g(精确到0.1 g),称量时通常使用的主要仪器的名称是_____。
(2)将样品溶解于过量的稀盐酸,过滤并洗涤滤渣。滤液中主要含有________,滤渣为________,溶解、过滤用到的玻璃仪器是________。
(3)向滤液中加过量的氢氧化钠溶液,过滤并洗涤滤渣。有关的离子方程式是________________________________________________________________。
(4)向步骤(3)的滤液中通入足量的二氧化碳气体,过滤并洗涤滤渣。有关的离子方程式是______________________________________________________________。
(5)将步骤(4)中所得的滤渣烘干并灼烧至恒重、冷却后称量,其质量为b g。有关反应的化学方程式是
_______________________________________________________________________,原样品中铝的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有原子序数依次增大的a、b、c、d四种元素,最外层电子数分别为4、1、x、7,已知c原子的电子层数等于x,d-的电子层结构与Ar元素相同。下列说法错误的是( )
A.元素a与氢形成原子比为1:1的化合物有多种
B.元素b的单质能与水、无水乙醇反应
C.c的简单离子与d-的简单离子最外层电子数和电子层数都不相同
D.元素a与元素d可形成既含有极性共价键又含非极性共价键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在科研、生活等方面有广泛用途。如图所示为从海带中制取碘的工艺流程。

已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
请回答下列问题:
(1)分液漏斗使用前需要检漏,检漏方法为__________。
(2)步骤X中,萃取后分液漏斗内观察到的现象是_____________。
(3)下列有关步骤Y的说法中正确的是_____(填字母)。
A.应控制NaOH溶液的浓度和体积
B.将碘单质转化成碘离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以用乙醇代替
(4)向“上层”中加入H2SO4溶液,发生反应的化学方程式为____,操作Z的名称为________。
(5)方案甲中采用蒸馏不合理,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥司他韦是一种高效、高选择性神经氨酸酶抑制剂,是目前治疗流感的最常用药物之一,是公认的抗禽流感、甲型H1N1等病毒最有效的药物之一。其合成路线如图所示:
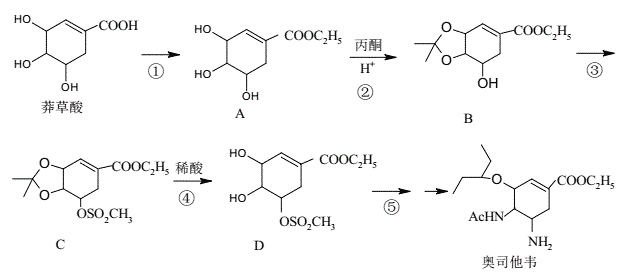
回答下列问题:
(1)莽草酸的含氧官能团名称有__;反应③的反应类型__。
(2)反应①的反应试剂和反应条件__。
(3)1molB最多可以消耗___molNaOH溶液。
(4)请写出反应②的化学方程式__。
(5)芳香化合物X是B的同分异构体,则符合官能团只含酚羟基的X有___种。
(6)设计由对甲基苯甲醛制备对醛基苯甲酸![]() 的合成路线__。
的合成路线__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将![]() 和
和![]() 两种酸溶液分别加水稀释至体积为
两种酸溶液分别加水稀释至体积为![]() ,稀释液
,稀释液![]() 与其体积变化的关系如图所示。下列说法正确的是 ( )
与其体积变化的关系如图所示。下列说法正确的是 ( )

A.![]() 和
和![]() 均为一元弱酸
均为一元弱酸
B.常温下,浓度均为![]() 的
的![]() 和
和![]() 溶液,溶液
溶液,溶液![]()
C.![]() 、
、![]() 两点对应溶液中一定存在:
两点对应溶液中一定存在:![]()
D.分别往![]() 、
、![]() 两点对应溶液中滴加
两点对应溶液中滴加![]() 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗![]() 溶液的体积相等
溶液的体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在中和热测定的实验中,以下操作正确的是:( )
①只在大烧杯底部垫泡沫塑料,使放入的小烧杯杯口与大烧杯杯口相平,再盖上硬纸板
②温度计测量过盐酸的温度后,立即插入![]() 溶液中测量
溶液中测量![]() 溶液的温度
溶液的温度
③将量筒中的![]() 溶液慢慢加入到小烧杯的盐酸中,边加边搅拌
溶液慢慢加入到小烧杯的盐酸中,边加边搅拌
④读取混合溶液的最高温度和最低温度,以其平均值记为最终温度.
A.只有①正确B.只有②正确
C.只有①④正确D.都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO47H2O)是医药上补血剂的有效成分。某课外小组测定该补血剂中铁元素含量的流程如下(已知其它成分在测定过程中不参与反应),回答下列问题:
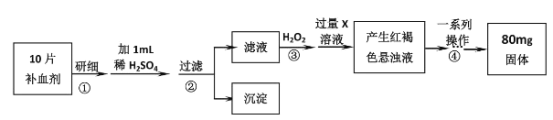
(1)步骤①研细的目的是_______。
(2)证明步骤②滤液中含有Fe2+的方法是_______。
(3)步骤③加入H2O2的目的_______,发生反应的离子方程式是_______。
(4)步骤③后过量X溶液是_______(填化学式)溶液。
(5)步骤④中一系列操作依次是_______、洗涤、灼烧、冷却、称量。
(6)假设实验无损耗,正常人每天应补充16.8mg左右的铁,如果全部通过服用上述测定的补血剂片来补充,则正常人每天需服用上述补血剂_______片。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com