
【题目】(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,反应的化学方程式_____________漂白粉的有效成分是__________(填化学式)。
(2)实验室制取氨气的化学方程式:__________________________________
(3)1.2gRSO4中含0.01molR2+,则RSO4的摩尔质量是______________;
(4)实验室制Fe(OH)2一般看不到白色的Fe(OH)2沉淀,原因___________________现象是:_________________________ 。反应的化学方程式:__________________________________
(5)碳酸钠水解反应的离子方程式(第一步):_________________________ 。
(6)铅蓄电池的负极反应式:_________________________ 。
(7)硫酸钡的沉淀溶解平衡:__________________________________。
【答案】2Cl2 + 2Ca(OH)2 = Ca(ClO)2 + CaCl2 +2 H2O Ca(ClO)2 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 120g/mol Fe(OH)2被空气中的氧气氧化 白色沉淀迅速变灰绿色最后变红褐色 反应的化学方程式:4Fe(OH)2+O2+2 H2O=4Fe(OH)3 CO32-+ H2O
CaCl2+2NH3↑+2H2O 120g/mol Fe(OH)2被空气中的氧气氧化 白色沉淀迅速变灰绿色最后变红褐色 反应的化学方程式:4Fe(OH)2+O2+2 H2O=4Fe(OH)3 CO32-+ H2O![]() OH-+H CO3- Pb-2e-+SO42-=PbSO4 BaSO4(s)
OH-+H CO3- Pb-2e-+SO42-=PbSO4 BaSO4(s) ![]() Ba2+ (aq)+SO42-(aq)
Ba2+ (aq)+SO42-(aq)
【解析】
(1)工业上将氯气通入石灰乳制取漂白粉,氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应方程式为2Cl2+2Ca(OH)2=Ca(ClO)2 +CaCl2+2H2O,次氯酸盐是漂白杀毒剂的有效成分,漂白粉的有效成分是Ca(ClO)2,故答案为:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,Ca(ClO)2。
(2)实验室用氯化铵和消石灰反应生成氨气和氯化钙、水,反应的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(3)1.2gRSO4中含0.01molR2+,根据公式n=m/M,则RSO4
的M=m/n=1.2g/0.01mol=120g/mol,RSO4的摩尔质量在数值上等于其相对分子质量,所以RSO4的摩尔质量为120g/mol,故答案为:120g/mol。
(4)实验室制Fe(OH)2一般看不到白色的Fe(OH)2沉淀,因为Fe(OH)2被空气中的氧气氧化,现象为:白色沉淀迅速变为灰绿色最后变为红褐色,反应的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:Fe(OH)2被空气中的氧气氧化,白色沉淀迅速变为灰绿色最后变为红褐色,4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(5)碳酸钠为强碱弱酸盐,水解呈碱性,且以第一步水解为主,水解方程式为CO32-+H2O![]() HCO3-+OH-,故答案为:CO32-+H2O
HCO3-+OH-,故答案为:CO32-+H2O![]() HCO3-+OH-。
HCO3-+OH-。
(6)由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,放电时,Pb被氧化,应为电池负极反应,电极反应式为Pb-2e-+SO42-=PbSO4,故答案为:Pb-2e-+SO42-=PbSO4。
(7)硫酸钡在水中存在沉淀溶解平衡:BaSO4(s)![]() Ba2+(aq)+SO42-(aq),故答案为:BaSO4(s)
Ba2+(aq)+SO42-(aq),故答案为:BaSO4(s)![]() Ba2+(aq)+SO42-(aq)。
Ba2+(aq)+SO42-(aq)。


科目:高中化学 来源: 题型:
【题目】已知反应A(g)![]() B(g) 2C(g)的平衡常数和温度的关系如下:
B(g) 2C(g)的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.70 | 1.10 | 1.00 | 0.60 | 0.40 |
回答下列问题:
(1)该反应的平衡常数表达式K![]() ____________,
____________,![]() ______0(填“﹤”“﹥”或“≒”)
______0(填“﹤”“﹥”或“≒”)
(2)容积固定,判断该反应是否达到平衡的依据为_______(填正确选项前的字母)。
a.气体的密度不随时间改变
b.![]() (A)不随时间改变
(A)不随时间改变
c.混合气体平均相对分子质量不随时间改变
d.压强不随时间改变
(3)1200℃时反应2C(g) ![]() A(g)
A(g)![]() B(g)的平衡常数值为____________。
B(g)的平衡常数值为____________。
(4)830℃时,向一个10.00L的密闭容器中充入0.40 mol的A和1.60 mol的B,如果反应初始2s内生成C的物质的量为0.40 mol,则2s内A的平均反应速率![]() (A)=____________
(A)=____________
mol·L-1·s-1;2s时![]() (B)= ___________mol·L-1;2s时A的转化率为___________;2s时C的体积分数为_______________。
(B)= ___________mol·L-1;2s时A的转化率为___________;2s时C的体积分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。
请回答下列问题:
(1)写出A、B、C、D、E、F的化学式
A________;B________;C________;D________;E________;F________。
(2)写出F和H反应的化学方程式 __________________________________。
(3)写出下列反应的离子方程式:
①D+盐酸 ________________________________________________;
②B+水 _____________________________________________________;
③D+A ______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,CH3COOH的电离常数Ka=1.8×10-5。常温下,往25ml氢氧化钠标准溶液中逐滴加入0.2 mol·L-1的CH3COOH溶液,pH变化曲线如下图所示:
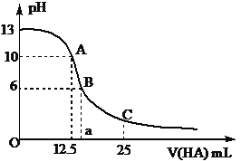
(1)该氢氧化钠溶液的物质的量浓度为________mol·L-1。
(2)A点对应酸的体积为12.5ml,则所得混合溶液中由水电离出的c(OH-)=____ mol·L-1。
(3)B点所示溶液中,c(CH3COO-)-c(Na+)=_______________ mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=_______。
(4)C点所示溶液中,c(CH3COOH)_______c(CH3COO-)。(填“>”、“<”或“=”)
(5)向300 mL上述NaOH溶液中通入448 mL CO2(标准状况)气体,充分反应后,溶液中粒子浓度关系正确的是________.
A.c(Na+)+ c(H+)= c(OH-)+ c(HCO3-)+ c(CO32-)
B.2/3c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3)
C.c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+)
D.c(Na+)> c(HCO3-)> c(CO32-)> c(OH-)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电影《流浪地球》讲述了太阳即将爆发氦闪”(3He![]() C),人类飞离太阳系的艰辛历程.太阳质量中氢占71%,氦26%,氧、碳、铁等元素占2%左右.下列说法正确的是
C),人类飞离太阳系的艰辛历程.太阳质量中氢占71%,氦26%,氧、碳、铁等元素占2%左右.下列说法正确的是
A. 核素![]() 的中子数比电子数多2
的中子数比电子数多2
B. 上述元素除氮之外仅能形成6种单质和4种氧化物
C. 碳、氢、氧元素组成的糖类物质均可发生水解
D. 上述元素组成的草酸亚铁(FeC2O4)中碳元素的化合价为+3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒熔点高、硬度大,具有良好的可塑性和低温抗腐蚀性.工业常用钒炉渣(主要含FeO·V2O3,还有少量Al2O3、CuO等杂质)提取金属钒,流程如图:

已知:
I.钒有多种价态,其中+5价最稳定.钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡:VO2++H2OVO3+2H+.
Ⅱ.部分离子的沉淀pH:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀PH | 5.2 | 7.6 | 2.7 |
完全沉淀PH | 6.4 | 9.6 | 3.7 |
回答下列问题
(1)碱浸步骤中最好选用______________(填字母)
a. NaOH溶液 b.氨水c.纯碱溶液
(2)焙烧的目的是将FeO·V2O3转化为可溶性NaVO3,其中铁元素全部转化为+3价的氧化物,写出该反应的化学方程式___________________________________
(3)溶液1到溶液2的过程中,调节pH至8有两个目的,一是除去________离子,二是促使_________.
(4)沉钒过程中得到NH4VO3沉淀需要洗涤,写出实验室洗涤的操作方法____________________.
(5)常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式____________________________.
(6)钒的化合物也有广泛的用途,如一种新型铝离子可充电电池的结构如图所示.
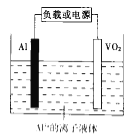
已知放电时电池反应为xAl+VO2=AlxVO2↓,则放电时正极的电极反应式为_____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种特殊的热激活电池示意图如下。该电池总反应为:PbSO4(s)+2LiCl+Ca(s)= CaCl2(s)+ Li2SO4+Pb(s) ,下列说法不正确的是

A. Ca电极发生氧化反应
B. 负极的电极反应:Ca(s)+2Cl﹣﹣2e﹣= CaCl2(s)
C. 可用 LiCl 和 KCl 水溶液代替无水 LiCl﹣KCl
D. 当无水LiCl﹣KCl混合物受热熔融后电池才能工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素T、X、Y、Z、W在元素周期表中的相对位置如下表所示,其中T的单质在一定条件下能与W的最高价氧化物对应水化物的浓溶液反应并生成两种酸性气体,则下列相关说法正确的是

A. 离子半径:X<Y<W
B. 最简单气态氢化物的热稳定性:W<Z
C. ![]() 分子中每个原子均满足8电子稳定结构
分子中每个原子均满足8电子稳定结构
D. 最高价氧化物对应水化物的碱性:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4是一种补血剂,常温下久置易变黄,一般认为是二价铁被氧化为三价铁的缘故。
(1)已知:①Fe2+(aq)-e-= Fe3+(aq) △H1=akJ/mol
②O2(g)+4 e-+4H+(aq)=2H2O(l) △H2=bkJ/mol
则FeSO4在酸性溶液中变质的热化学方程式为_____ 。
常温下,配制浓度为0.1mol/L的FeSO4溶液,研究不同 pH 对Fe2+ 氧化的影响,结果如下图所示,(假设反应过程中溶液体积不变)。

(2)在pH=5.5的环境下,该反应在0~15min的平均速率v(Fe2+)=_______;增大溶液pH,Fe2+被氧化速率_______(填“增大”、“减小”或“无影响”)。
(3)在平衡常数的计算中气态物质常以压强代替其浓度,Fe2+在酸性环境下氧化的平衡常数K的计算表达式是______;常温下该反应的平衡常数很大,为2.5×1032L4 /(atmmol4),下列说法正确的是_______。
a. Fe2+转化为Fe3+的趋势大 b. Fe2+转化为Fe3+的速率大
c. 反应进行得较为彻底 d. 酸性条件下Fe2+不会被氧化
(4)在pH=13的环境下,Fe2+的氧化变质可以理解为:
第一步: Fe2++2OH-= Fe(OH)2,第二步_____________ (用化学方程式回答);当氧化达到平衡时,c(Fe2+)/ c(Fe3+)_____4.0×1022(填“>”“<”或“=”)。已知的Ksp[Fe(OH)3]=2.5×10-39,Ksp[Fe(OH)2]=1.0×10-15。
(5)根据上述分析,配制FeSO4溶液的正确方法是加入适量的铁粉和_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com