
【题目】KMnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等。
(1)在K2MnO4溶液中通入CO2可制得高锰酸钾,副产物是黑色沉淀M。该反应中氧化剂与还原剂的质量之比为__________________。由锂离子有机高聚物、锂及M构成原电池,电池反应为Li+M=LiM(s),消耗8.7gM时转移0.1mol电子。则该电池正极的电极反应为___________________________________。
(2)实验室用KMnO4制备O2和Cl2。取0.4mol KMnO4固体加热一段时间后,收集到
amolO2,在反应后的残留固体中加入足量浓盐酸,加热又收集到bmolCl2。设锰元素全部
转化成Mn2+存在于溶液中,当a+b=0.8mol时,在标准状况下生成Cl2的体积为______L;
(3)电解K2MnO4溶液加以制备KMnO4。工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4 ,化学方程式为_______________________________。用镍片作阳极(镍不参与反应),铁板为阴极,电解K2MnO4溶液可制备KMnO4。上述过程用流程图表示如下:

则D的化学式为___________;阳极的电极反应式为_____________________;阳离子迁移方向是___________________。
(4)高锰酸钾在酸性介质中还原产物为Mn2+,废液中c(Mn2+)浓度较大时会污染水体。实验室可以用过二硫酸铵[(NH4)2S2O8]溶液检验废水中Mn2+,实验现象是溶液变紫红色(还原产物为SO42-)。过二硫酸可以看成是H2O2的衍生物,过二硫酸铵中含有过氧键(-O-O-)。写出检验Mn2+的离子方程式_________________________________。如果将这个反应设计成盐桥原电池,盐桥中溶液最好选用______________。(选填:饱和KCl溶液、饱和K2SO4溶液或饱和NH4Cl溶液)
【答案】 1︰2 MnO2+e-+Li+= LiMnO2 13.44 2MnO2+4KOH +O2![]() 2K2MnO4+2H2O KOH MnO42--e-= MnO4- K+由阳离子交换膜左侧向右侧迁移 2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+ 饱和K2SO4溶液
2K2MnO4+2H2O KOH MnO42--e-= MnO4- K+由阳离子交换膜左侧向右侧迁移 2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+ 饱和K2SO4溶液
【解析】(1)由已知,反应物为K2MnO4、CO2,生成KMnO4,根据C原子守恒,生成物还应有K2CO3,黑色固体M必为MnO2,所以的化学方程式为:3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3;由化学反应方程式分析可得:氧化剂和还原剂均为K2MnO4,氧化剂与还原剂的质量比为1:2;由锂离子有机高聚物、锂及MnO2构成原电池,电池反应为Li+MnO2=LiMnO2(s),负极上发生失电子的氧化反应:Li-e﹣=Li+,正极上发生得电子的还原反应:MnO2+e﹣+Li+=LiMnO2,故答案为:1:2;MnO2+e﹣+Li+=LiMnO2。
(2)Mn元素由+7价降为+2价,O元素由-2价升为0价,Cl元素由-1价升为0价,由题意根据得失电子守恒,整个过程中,Mn元素获得的电子等于O元素、Cl元素失去的电子,则有:0.4mol×(7﹣2)=4a+2b=2mol;又因为a+b=0.8mol,解得a=0.2,b=0.6,所以生成标准状况下Cl2的体积为0.6mol×22.4L/mol=13.44L。
(3)由已知,软锰矿(主要成分是MnO2)与KOH小火加热至熔融,得到K2MnO4,Mn元素化合价由+4价升为+6价,则空气中的O2作氧化剂,化学方程式为:2MnO2+4KOH+O2![]() 2K2MnO4+2H2O;电解锰酸钾溶液时阴极上水得电子生成氢气和氢氧根离子,电极反应式为:2H2O+2e﹣=H2↑+2OH﹣,K+通过阳离子交换膜由左侧向右侧迁移,所以D是氢氧化钾溶液,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为:MnO42﹣﹣e﹣=MnO4﹣。
2K2MnO4+2H2O;电解锰酸钾溶液时阴极上水得电子生成氢气和氢氧根离子,电极反应式为:2H2O+2e﹣=H2↑+2OH﹣,K+通过阳离子交换膜由左侧向右侧迁移,所以D是氢氧化钾溶液,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为:MnO42﹣﹣e﹣=MnO4﹣。
(4)由已知,在酸性介质中,Mn2+被(NH4)2S2O8溶液氧化为MnO4﹣,还原产物为SO42-,所以离子方程式为:2Mn2++5S2O82﹣+8H2O=2MnO4﹣+10SO42﹣+16H+;因为(NH4)2S2O8溶液具有强氧化性,所以如果将这个反应设计成盐桥原电池,盐桥中溶液最好选用不能被氧化的物质,可以选择饱和K2SO4溶液。


科目:高中化学 来源: 题型:
【题目】某化学小组设计了如图1所示的数字化实验装置,研究常温下,向1L 0.1mol/LH2A溶液中逐滴加入等浓度NaOH溶液时的pH变化情况,并绘制出溶液中含A元素的微粒的物质的量分数与溶液pH的关系如图2所示,则下列说法中不正确的是

A. pH=4.0时,图中n(HA-)约为0.0091mol
B. 该实验应将左边的酸式滴定管换成右边碱式滴定管并加酚酞作指示剂
C. 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
D. 0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。这里用到的实验方法可用于分离
A. 苯和水 B. 食盐水和泥沙
C. 乙酸乙酯和乙酸 D. 硝酸钾和硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氢键,下列说法正确的是( )
A.分子间形成的氢键使物质的熔点和沸点升高
B.冰中存在氢键,水中不存在氢键
C.每一个水分子内含有两个氢键
D.H2O是一种非常稳定的化合物,这是由于氢键所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题。
(1)下列物质能导电且属于电解质的是________(填序号)。
A. 固态氯化镁(MgCl2) B. 液态氯化镁(MgCl2)
C. 氯化钠溶液D. 铝
(2)写出下列物质在水溶液中的电离方程式:
①Na2CO3______________;
②H2SO4______________;
③KHSO4_____________。
(3)有人说可将无机化合物KHSO4与NaHCO3归为同一类别,你认为他的理由主要是_____;有人说可将无机化合物KHSO4与H2SO4归为同一类别,你认为他的理由主要是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 ![]() 溶液中逐滴加入稀硫酸。请完成下列问题:
溶液中逐滴加入稀硫酸。请完成下列问题:
(1)写出反应的离子方程式:__________________________。
(2)下列三种情况下,离子方程式与(1)相同的是__________(填序号)。
A. 向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液至溶液显中性
溶液至溶液显中性
B. 向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液至
溶液至![]() 恰好完全沉淀
恰好完全沉淀
C. 向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液至沉淀完全
溶液至沉淀完全
(3)若缓缓加入稀硫酸至过量,整个过程中混合溶液的导电能力可以近似地用图中的_____(填序号)曲线表示。
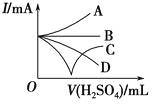
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙酸和乙醇在浓硫酸催化下会发生下列反应:

CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
CH3CH2OH+CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
CH3CH2OH![]() CH2===CH2↑+H2O
CH2===CH2↑+H2O
沸点:乙醇78.5 ℃、乙酸117.9 ℃、乙酸乙酯77.1 ℃
某同学为了在实验室制备乙酸乙酯,设计了如下图所示的装置(部分类持仪器省略)。
实验步骤:
①在干燥的100 mL三颈烧瓶中加入8 mL 95%的乙醇,在冷水冷却下,边摇边慢慢加入8 mL浓硫酸,加入碎瓷片;在滴液漏斗中加入8 mL 95%的乙醇和8 mL乙酸,摇匀。按图组装仪器。滴液漏斗的末端和温度计的水银球必须浸到液面以下距瓶底0.5 cm~1 cm处。
②用电热套加热烧瓶,当温度计读数上升到110 ℃时,从滴液漏斗中滴加乙醇和乙酸混合液(速度为每分钟30滴为宜),并维持适宜的反应温度。滴加完毕,继续加热数分钟,直到反应液温度升到130 ℃,不再有馏出液为止。
③洗涤粗产物。
请回答下列问题:
(1)碎瓷片的作用是_____________________________________________。
冷凝管的作用是________________________________,水要从______(填“A”或“B”)口进入。馏出液的成分有_______________________________。
(2)整个实验过程要严格控制温度在________℃左右,否则会________________。
(3)洗涤粗产物的方法是:向粗产物中慢慢加入________溶液,然后用分液法分离。下列有关分液操作的叙述正确的是________(填字母序号)。
a.应选用球形分液漏斗进行分液,使用前要检查是否漏水
b.将混合液倒入分液漏斗,塞紧玻璃塞,上下振荡
c.混合液摇匀后,立即将分液漏斗放在铁圈上静置,分层
d.打开分液漏斗的玻璃塞,再打开旋塞,使下层液体从分液漏斗下端放出,待下层液体完全流出后关闭旋塞,把上层液体从分液漏斗上口倒出
(4)为了得到更纯的产物,需向(3)中得到的酯中加入无水硫酸镁进行干燥,然后通过________法分离。
下列区分乙酸乙酯精品和粗品的方法,不合理的是______________。
a.用溴水检验 b.用金属钠检验
c.测定沸点 d.用新制Cu(OH)2悬浊液检验
(5)本实验如何创造条件使酯化反应尽量向生成物方向进行?(至少提出两点)
①________________________________________________________;
②________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氯消毒剂给自来水消毒后有余氯Na2S2O3可用于自来水中余氯的测定。测定自来水中余氯含量的方案如下:在250 mL碘量瓶中(或具塞锥形瓶中)放置0.5 g碘化钾,加10 mL稀硫酸,准确量取流动水样100 mL(打开自来水龙头,待水流数十秒后再取水样) 置于碘量瓶,迅速塞上塞摇动,见水样呈淡黄色,加1 mL淀粉溶液变蓝,则说明水样中有余氯。再以c mol·L-1标准Na2S2O3溶液滴定,至溶液蓝色消失呈无色透明溶液,记下消耗硫代硫酸钠溶液的体积。
(已知:滴定时反应的化学方程式为I2+2Na2S2O3===2NaI+Na2S4O6)
(1)若该自来水是以漂白粉消毒,能说明水样中有余氯的反应离子方程式为_______________________________________________________。
(2)按上述方案实验,消耗标准Na2S2O3溶液V mL,该次实验测得自来水样品中余氯量(以游离Cl2计算)为________mg·L-1。在上述实验过程中,若“塞上塞摇动”动作不够迅速,则测得结果________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室制取CO2的离子反应方程式:________________________________________;
(2)CO2与足量的NaOH溶液反应的离子方程式:________________________________;
(3)氢氧化铁胶体制备的离子反应:_____________________________________________;
(4)同温同压条件下,N2与O2的摩尔质量比为:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com