
【题目】测血钙的含量时,进行如下实验:
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0-4 mol./L的KMnO4溶液。
(1)写出用KMn04滴定H2C2O4的离子方程式___________。
(2)判断滴定终点的方法是____________。
(3)③步骤中取酸性KMnO4溶液溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的血钙质量分数_______(填“偏大”、“偏小”或“无影响”)。
(4)计算:血液中含钙离子的浓度为_____mol/L。
【答案】 2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O 当滴入最后一滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色 偏大 2.5×10-3
【解析】(1)用酸性KMnO4溶液滴定H2C2O4溶液,高锰酸钾具有强氧化性能氧化草酸生成CO2、Mn2+,配平可得离子方程式。故答案为:2MnO4﹣+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O;
(2)H2C2O4反应完之前,溶液是无色的,当草酸与高锰酸钾恰好完全反应,再滴高锰酸钾,溶液瞬间变为紫红色,此为滴定终点。故答案为:当滴入最后一滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色;
(3)装液前滴定管需要润洗,若没有润洗,则滴定管中残留蒸馏水将高锰酸钾溶液稀释,所以滴定过程中消耗高锰酸钾溶液体积增大,计算测得的血钙质量分数偏大。
故答案为:偏大;
(4)根据定量关系可知,5CaC2O4~5H2C2O4~2KMnO4,
5 2
n 0.020L×l.0×l0﹣4 mol/L
所以,n=5.0×10﹣6mol,钙离子的浓度= ![]() ;
;
故答案为:2.5×10﹣3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(6分)对实验:①中和滴定、②中和热的测定、③实验室制备乙烯、④乙酸乙酯的制取,叙述正确的是( )
A. ①④必须加热 B. ②③必须隔热 C. ①②必须用指示剂 D. ③④必须用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A. a 点所示溶液中 c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b 两点所示溶液中水的电离程度相问
C. b点所示溶液中c(A-)>c(HA)
D. pH=7时,c(Na+)=c(A-)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的物质转化关系中.A是常见气态氢化物,B是能使带火星的木条复燃的无色无味气体,E的相对分子质量比D大17,G是一种紫红色金属单质.(部分反应中生成物没有全部列出,反应条件未列出) 
请回答下列问题:
(1)B的化学式为 .
(2)A的电子式为 .
(3)反应①的化学方程式为 .
(4)反应②的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以烃A为主要原料,采用以下路线合成药物X和高聚物Y:

已知: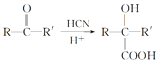 (R或R′可以是烃基或H原子)。
(R或R′可以是烃基或H原子)。
请回答下列问题:
(1)X的分子式为____________,X中的含氧官能团有____________。
(2)若反应①、反应②的原子利用率均为100%,则A的名称为________。
(3)E的结构简式为________________,反应③的条件是________,反应⑤的反应类型是________。
(4)写出反应④的化学方程式: ___________________________________。
(5)写出同时符合下列条件的E的所有同分异构体的结构简式:________。
①属于酚类化合物,且是苯的对位二元取代物;
②能发生银镜反应和水解反应。
(6)以CH3CHO为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种高能燃料,常温下为无色具有强烈的吸水性的有毒液体。熔点(2℃),沸点(113.5℃)。N2H4水溶液的碱性弱于氨水;N2H4有强还原性。化学小组同学在实验室中用过量NH3和NaC1O溶液反应制取N2H4并探究其性质。回答下列问题:

(1)A中反应容器的名称为_____________
(2)用上图装置制取肼,其连接顺序为________(按气流方向,用小写字母表示)。
(3)装置A中生成N2H4·H2O,则发生反应的化学方程式为_________________,装置D的作用是_______________。
(4)用化学用语解释N2H4水溶液呈碱性的原因:__________________________________
(5)发射火箭时,肼为燃料,双氧水为氧化剂,两者反应生成氮气和气态水。已知1.6g液态肼 在上述反应中释放64.22kJ 的热量,写出该反应的热化学方程式:_______________________
(6)将A中得到的粗产品和烧碱混合,逐渐通入氮气以除空气,目的为_______________加热至碱液温度近110℃,待烧碱完全溶解后,冷却到60℃左右,进行 至蒸馏液含肼量90%~94%,再经分馏、除去水分后,冷凝,制得98%~99.5%的无水肼。则空白处应填写(_____)
A.加压蒸馏 B.常压蒸馏 C.真空蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L NaOH溶液滴定 20.00mL 0.1000 mol/L
CH3COOH溶液滴定曲线如右图。下列说法正确的是

A. 点①所示溶液中:c(CH3COO-)+ c(OH-) =c(CH3COOH)+ c(H+)
B. 点②所示溶液中:c(Na+) =c(CH3COOH)+ c(CH3COO-)
C. 点③所示溶液中:c(Na+)> c(OH-)> c(CH3COO-)> c(H+)
D. 滴定过程中可能出现:c(CH3COOH)> c(CH3COO-)> c(H+)> c(Na+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷是人体含量较多的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛。回答下列问题:
(1)基态磷原子的核外电子排布式为____________________。
(2)P4S3可用于制造火柴,其分子结构如图甲所示。

①第一电离能:磷_____________硫;电负性:磷_____________硫(填“>”或“<”)。
②P4S3分子中硫原子的杂化轨道类型为_____________。
③每个P4S3分子中含孤电子对的数目为______________。
(3)N、P、As、Sb均是第VA族的元素。
①上述元素的氢化物的佛点关系如图乙所示,沸点:PH3<NH3,其原因是____________;沸点:PH3<AsH3<SbH3,其原因是______________________________________。

②某种磁性氮化铁的晶胞结构如图丙所示,该化合物的化学式为______。
(4)磷化铝熔点为2000℃,它与晶体硅互为等电子体,磷化铝晶胞结构如图丁所示。
①磷化铝晶体中磷与铝微粒间的作用力为_____________________。
②图中A点和B点的原子坐标参数如图丁所示,则C点的原子坐标参数为________。
③磷化铝晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为___________cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com