
【题目】一种重要的有机化工原料有机物X,如图是以它为初始原料设计出的转化关系图(部分产物、合成路线、反应条件略去)。Y是一种功能高分子材料。
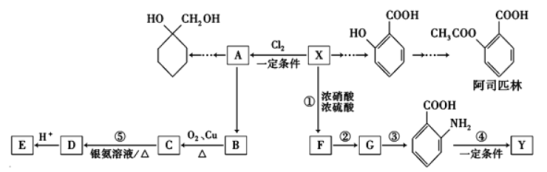
已知:①X为芳香烃,其相对分子质量为92
②烷基苯在高锰酸钾的作用下,侧链被氧化成羧基:![]()
③ ![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)X的分子式为_____________;
(2)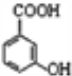 中官能团的名称为___________________;
中官能团的名称为___________________;
(3)反应③的反应类型是_____________;已知A为一氯代物,则E的结构简式为_______________;
(4)反应④的化学方程式为_______________________________________;
(5)阿司匹林有多种同分异构体,满足下列条件的同分异构体有_______种:
①含有苯环;
②既不能发生水解反应,也不能发生银镜反应;
③1mol该有机物能与2molNaHCO3完全反应.
【答案】 C7H8 (酚)羟基、羧基 还原反应 ![]() n
n ![]()
![]()
 +(n-1)H2O 10
+(n-1)H2O 10
【解析】相对分子质量为92的某芳香烃X,则由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃X的分子式为C7H8, 结构简式为![]() ,X与氯气发生取代反应生成一氯代物A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,则A为
,X与氯气发生取代反应生成一氯代物A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,则A为![]() ,B为
,B为 ,C为
,C为![]() ,D酸化生成E,D为
,D酸化生成E,D为 ,E为
,E为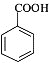 ;
;![]() 在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为
在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为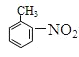 , F转化生成G,由信息可知G为
, F转化生成G,由信息可知G为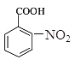 ,Y是一种功能高分子,链节组成为C7H5NO,与
,Y是一种功能高分子,链节组成为C7H5NO,与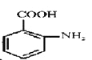 的分子式相比减少1分子H2O,则为通过形成肽键发生缩聚反应生成的高聚物,则Y为
的分子式相比减少1分子H2O,则为通过形成肽键发生缩聚反应生成的高聚物,则Y为 ;
;
(1)X为芳香烃,一定含有苯环(相对分子质量为78),X的其相对分子质量为92,则一定为甲苯,分子式为C7H8;
(2)根据官能团的特征,![]() 中官能团为羟基和羧基;
中官能团为羟基和羧基;
(3)X为甲苯,根据流程图可知,甲苯与浓硝酸、浓硫酸发生硝化反应生成邻硝基甲苯,邻硝基甲苯被酸性高锰酸钾氧化,发生氧化反应生成邻硝基苯甲酸,邻硝基苯甲酸发生还原反应生成![]() ,所以反应③的反应类型是还原反应;X是甲苯,根据流程图可知,X与氯气反应生成一氯甲苯,一氯甲苯发生取代反应生成苯甲醇,苯甲醇发生催化氧化反应生成苯甲醛,苯甲醛与银氨溶液反应再酸化,生成苯甲酸,则E的结构简式是
,所以反应③的反应类型是还原反应;X是甲苯,根据流程图可知,X与氯气反应生成一氯甲苯,一氯甲苯发生取代反应生成苯甲醇,苯甲醇发生催化氧化反应生成苯甲醛,苯甲醛与银氨溶液反应再酸化,生成苯甲酸,则E的结构简式是![]() 。
。
(4)Y是一种功能高分子材料,则![]() 发生缩聚反应生成高分子化合物,所以反应④的化学方程式为n
发生缩聚反应生成高分子化合物,所以反应④的化学方程式为n![]()
![]()
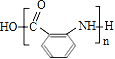 +(n-1)H2O。
+(n-1)H2O。
(5)阿司匹林有多种同分异构体,满足下列条件的同分异构体,①含有苯环;②既不能发生水解反应,也不能发生银镜反应,说明没有酯基,也没有醛基;③1mol该有机物能与2molNaHCO3完全反应,说明有2个羧基,则苯环上有一个取代基的1种,两个取代基的3种(邻、间、对),3个取代基的有6种,分别是两个羧基在邻位的有2种,2个羧基在对位的有1种,2个羧基在间位的有3中,一个10种。


科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )

选项 | W | X |
A | 稀硫酸 | NaAlO2溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,11.2 LCH2Cl2含极性共价健数目为2NA
B. 1mol甲基(![]() )所含的电子数为7NA
)所含的电子数为7NA
C. 30g葡萄糖和乙酸的混合物中含碳原子数为NA
D. 1 mol有机物![]() 中最多有6NA个原子在一条直线上
中最多有6NA个原子在一条直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列物质:①1H、2H、3H ;②H2O、D2O、T2O;③O2、O3;④12C、14C
(1)互为同位素的是______(填序号,下同);
(2)互为同素异形体的是_____;
(3)氢的三种原子1H、2H、3H与氯的两种原子35Cl、37Cl相互结合为氯化氢,可得分子中相对分子质量不同的有___种;
Ⅱ.用化学用语回答下列问题:
(1)写出NaOH的电子式____;
(2)用电子式表示二氧化碳分子的形成过程____;
下列物质:①N2②H2O2③NH3④Na2O ⑤NH4Cl
(3)含有极性键和非极性键的是_______(填序号,下同);
(4)含有极性键的离子化合物是_________;
(5)氟化氢水溶液中存在的氢键有________种;
(6)分子(CN)2分子中每个原子最外层均满足8电子稳定结构,其结构式为_____。
Ⅲ.正交硫和单斜硫是硫元素的两种常见单质,其晶状结构如左下图所示;构成晶体的微粒均是S8分子,其分子结构如右下图所示。回答下列问题:

已知正交硫的熔点为112.8℃,沸点为444.6℃,硬度较小。晶状的正交硫的微粒间存在在相互作用力有:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从定性分析到定量研究是高中生化学学习的重要发展历程。请你根据所学知识对以下化学问题进行定量分析。
(1)高锰酸钾是一种典型的强氧化剂。在用KMnO4酸性溶液处理CuS的混合物时,发生的反应如下:6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O,请用单线桥法标出该反应中电子转移的方向和数目:
6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O ________________
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol, 则转移的电子数为__________, 被氧化的N原子的物质的量为__________。
(3)实验室需要为无土栽培配制1 L内含0.24 mol K2SO4、0.5 mol NH4Cl、0.16 mol KCl的某营养液。某小组计划用(NH4)2SO4、KCl、NH4Cl配制,则需这三种固体的物质的量分别为_________、_________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与![]() ===
===![]() 相比较,水的作用不相同的是( )
相比较,水的作用不相同的是( )
A. ![]() ===
===![]() ↑
↑
B. ![]() ===
===![]()
C. ![]() ===
===![]()
D. ![]() ===
===![]() ↑
↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A.NaHCO3受热易分解,可用于制胃酸中和剂
B.SiO2熔点高、硬度大,可用于制光导纤维
C.Al2O3是两性氧化物,可用作耐高温材料
D.硅胶多孔能吸水,可用作食品干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】陶瓷是火与土的结晶,其形成、性质与化学有着密切的关系,下列说法错误的是( )
A.瓷器青色,来自氧化铁B.陶瓷由粘土经高温烧结而成
C.陶瓷主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有抗氧化等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧族元素是指位于元素周期表第16列的元素,包括氧、硫、硒(Se)、碲(Te)、钋(Po)、鉝(Lv)六种元素。请回答下列问题:
(1)O及与O同周期的相邻元素,第一电离能由大到小的顺序为_________。
(2)S有+4和+6两种价态的氧化物。
①下列关于气态SO3和SO2的说法中正确的是______ (填选项字母)。
A.中心原子的价层电子对数目相等 B.都是极性分子
C.中心原子的孤对电子数目相等 D.都含有极性键
②SO3分子的空间构型为_________,与其互为等电子体的阴离子为______(举一例)。将纯液态SO3冷却到289.8 K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中硫原子的杂化轨道类型是___。

(3)元素X与硒同周期,X元素原子核外未成对电子数最多,X为____(填元素符号),X的基态原子的电子排布式为_____。
(4)单质钋(Po)是简单立方堆积的金属晶体,若已知Po的摩尔质量为M g·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA,则钋晶体的密度的表达式为___g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com