
【题目】据报道科研人员应用计算机模拟出结构类似C60的物质N60 。已知:①. N60分子中每个氮原子均以N—N键结合三个N原子而形成8电子稳定结构;②.N—N键的键能为167 kJ/mol,N≡N键的键能为942kJ/mol。试回答下列问题:
(1)N60组成的晶体为_______ 晶体,其熔、沸点比N2的 _______(高或低),其原因是__________ 。
(2)1mol N60 分解成N2时吸收或释放的热量为________________kJ。
(3)常温常压下,向50 mL 0.4mol/L的NaOH溶液中加入过量的稀H2SO4,测得放热 a kJ.写出上述反应的热化学方程式:____________ 。
【答案】 分子 高 N60、N2均形成分子晶体,且N60的相对分子质量大,分子间作用力大,故熔、沸点高 13230 NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l) △H=-50a kJ/mol
【解析】(1)N60晶体的构成微粒为分子,所以属于分子晶体;分子晶体中结构和组成相似,其相对分子质量越大熔、沸点越高,N60和N2都是分子晶体,N60相对分子质量大于N2,所以N60的熔、沸点比N2高,故答案为:分子;高;N60和N2都是分子晶体,N60相对分子质量大于N2,分子间作用力大,所以N60的熔、沸点比N2高;
(2)每个N原子均以氮氮单键结合三个氮原子,每个氮氮键被2个氮原子共用,每个氮原子有1.5个氮氮键,1个N60分子的结构中含有90个N-N键,则1molN60的总键能为167kJmol-1×90mol=15030kJ,生成30molN≡N键的键能为942kJmol-1×30mol=28260kJ,则反应放出能量为28260kJ-15030kJ=13230 kJ,1mol N60分解成N2时放出热量13230kJ, 故答案为:13230;
(3)50 mL 0.4mol/L的NaOH中含有氢氧化钠0.050 L ×0.4mol/L=0.002mol,反应生成0.02mol水,则生成1mol水放出的热量为![]() ×a kJ=50a kJ,该反应的热化学方程式为NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O (l) △H=-50a kJ/mol,故答案为:NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O (l) △H=-50a kJ/mol。
×a kJ=50a kJ,该反应的热化学方程式为NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O (l) △H=-50a kJ/mol,故答案为:NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O (l) △H=-50a kJ/mol。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.淀粉、纤维素及其水解产物均属于糖类
B.天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点
C.蛋白质溶液中加硫酸铵或氯化铜溶液,均会发生蛋白质的变性
D.糖类、油脂、蛋白质均能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯是一种食用香料,其结构简式为: ![]() 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )
A.分子式为C10H14
B.一定条件下,柠檬烯可以发生加成、取代、氧化、还原反应
C.柠檬烯有属于苯的同系物的同分异构体
D.柠檬烯的分子中所有碳原子可能处在同一个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用盖斯定律可计算一些不易测定的反应的反应热.
(1)已知在298K时下述反应的有关数据:C(s)+ ![]() O2(g)=CO(g)△H1=﹣110.5kJmol﹣1 , C(s)+O2(g)=CO2(g)△H2=﹣393.5kJmol﹣1 . 则C(s)+CO2(g)=2CO(g) 的△H为 .
O2(g)=CO(g)△H1=﹣110.5kJmol﹣1 , C(s)+O2(g)=CO2(g)△H2=﹣393.5kJmol﹣1 . 则C(s)+CO2(g)=2CO(g) 的△H为 .
(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气.已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJmol﹣l;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJmol﹣l . 则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列除杂的离子方程式,括号内的物质为杂质.
物质(杂质) | 离子方程式 |
FeCl2 (FeCl3) | (1) |
CO2 (HCl) | (2) |
NaHC03 溶液(Na2C03) | (3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
2CH3CH2CH2CH2OH ![]() (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O
反应物和产物的相关数据如下
相对分子质量 | 沸点/℃ | 密度/(gcm﹣3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成反应:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.分离提纯.
③待A中液体冷却后将其缓慢倒人盛有70mL水的分液谝斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为 .
(2)加热A前,需先从 (填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去 , 振摇后静置,粗产物应从分液漏斗的(填“上”或“下”)口分离出.
(4)步骤③巾最后一次水洗的目的为 .
(5)步骤⑤中,加热蒸馏时应收集(填选项字母)左右的馏分.a.100℃b.117℃c. 135℃d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为 , 下层液体的主要成分为 .
(7)本实验中,正丁醚的产率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在1L的密闭容器中充入NO2发生如下反应:2NO2(g)N2O4(g);△H=﹣57kJmol﹣1
(1)该反应的△S0(填“>”、“<”或“=”).
(2)当开始充入0.03mol的NO2时,25℃时,实验测得NO2的平衡浓度为0.01molL﹣1 , 则NO2的平衡转化率(α)是 . 25℃时上述反应的平衡常数K= .
(3)25℃时,实验测得该反应的活化能Ea=92.4kJmol﹣1 . 下列能量关系图合理的是 . 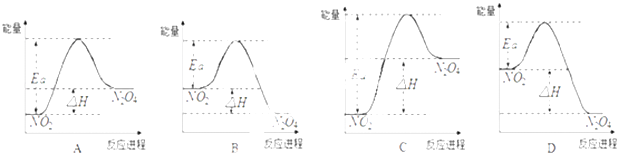
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液,一定呈中性的是
A. 由等体积、等物质的量浓度的硫酸跟NaOH溶液混合后所形成的溶液
B. c(H+)=1.0×10-7mol·L-1的溶液
C. pH=7的溶液
D. c(H+)=![]() 的溶液(Kw为该温度下水的离子积常数)
的溶液(Kw为该温度下水的离子积常数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com