
【题目】铝、锌、铁在人类生产和生活中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Fe2+电子排布式为___,Zn的基态原子能级最高的电子的电子云轮廓图形状为___。
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因___。
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键___mol,其阴离子中心原子的杂化方式是___,NH3的沸点高于PH3的原因是___。
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:___。
(5)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为___,其中Fe的配位数为___。
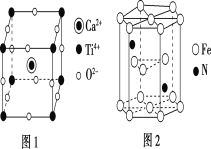
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xcm,高为ycm,NA为阿伏加德罗常数的值,则晶胞的密度为___g·cm-3(列出计算式即可)。
【答案】[Ar]3d6 球型 Mg 的电子排布式为[Ne]3s2 ,Al 的电子排布式为[Ne]3s2 3p1 ,镁的 3s 处于全满状态,较稳定不易失去一个电子,铝的最外层为3p1 ,易失去一个电子形成稳定结构 24 sp3 氨分子之间形成分子间氢键 3d 轨道上没有未成对电子(或 3d 轨道全空或全满状态) ![]() 4
4 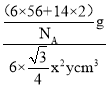
【解析】
(1)铁为26号元素,基态原子电子排布式为[Ar]3d6 4s2,所以Fe2+电子排布式为[Ar]3d6;Zn为30号元素,基态原子能级最高的电子为4s上的2个电子,所有电子云轮廓图形状为球形,故答案为:[Ar]3d6 球形;
(2)Mg的电子排布式为[Ne]3s2,Al的电子排布式为[Ne]3s2 3p1,镁的3s处于全满状态,较稳定,不易失去一个电子,铝的最外层为 3p1,易失去一个电子形成稳定结构,所以 Al 原子的第一电离能比Mg大,故答案为:Mg 的电子排布式为[Ne]3s2 ,Al 的电子排布式为[Ne]3s2 3p1,镁的3s处于全满状态,较稳定不易失去一个电子,铝的最外层为3p1 ,易失去一个电子形成稳定结构;
(3)[Zn(NH3)6] 2+中每个N原子形成3个氮氢σ键,与Zn2+形成1个配位键,配位键也属于σ键,所以1mol该离子中σ键为24 mol;阴离子为![]() ,根据价层电子对互斥理论,其中心原子S的价电子对为
,根据价层电子对互斥理论,其中心原子S的价电子对为![]() 对,所以中心S为sp 3杂化。NH3分子中 N原子的电负性强,原子半径小,使得N—H键的极性增强而表现一定的电性,分子之间能够形成氢键,而PH3分子中P半径大,电负性小,则不能形成分子间氢键,只存在范德华力,氢键的作用力强于范德华力,所以沸点NH3大于PH3,故答案为:24 sp 3 氨分子之间形成分子间氢键;
对,所以中心S为sp 3杂化。NH3分子中 N原子的电负性强,原子半径小,使得N—H键的极性增强而表现一定的电性,分子之间能够形成氢键,而PH3分子中P半径大,电负性小,则不能形成分子间氢键,只存在范德华力,氢键的作用力强于范德华力,所以沸点NH3大于PH3,故答案为:24 sp 3 氨分子之间形成分子间氢键;
(4)Sc3+的外围电子排布式为[Ar]3d0 、Cr3+的外围电子排布式为[Ar]3d3 、Fe2+电子排布式为 [Ar]3d6 、Zn2+的外围电子排布式为[Ar]3d10,对比四种离子的外围电子排布式可知,其水合离子的颜色与3d轨道上的单电子有关,故答案为:3d 轨道上没有未成对电子(或 3d 轨道全空或全满状态);
(5)Fe能够提供空轨道,而Cl能够提供孤电子对,故 FeCl3分子双聚时可形成配位键。由常见AlCl3的双聚分子的结构可知FeCl3的双聚分子的结构式为![]() ,其中 Fe的配位数为4,故答案为:
,其中 Fe的配位数为4,故答案为:![]() 4 ;
4 ;
(6)由图示,堆积方式为六方最紧密堆积。为了计算的方便,选取该六棱柱结构进行计算:六棱柱顶点的原子是6个六棱柱共用的,面心是两个六棱柱共用,所以该六棱柱中的铁原子为 ![]() 个,N原子位于六棱柱内部,所以该六棱柱中的氮原子为2个,该结构的质量为
个,N原子位于六棱柱内部,所以该六棱柱中的氮原子为2个,该结构的质量为![]() ,该六棱柱的底面为正六边形,边长为x cm,底面的面积为6个边长为x cm 的正三角形面积之和,根据正三角形面积的计算公式,该底面的面积为
,该六棱柱的底面为正六边形,边长为x cm,底面的面积为6个边长为x cm 的正三角形面积之和,根据正三角形面积的计算公式,该底面的面积为 ![]() cm2 ,高为 y cm,所以体积为
cm2 ,高为 y cm,所以体积为![]() cm3。所以密度为:
cm3。所以密度为: 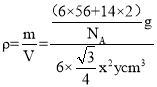 ,故答案为:
,故答案为: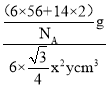 。
。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应2AB+3C,在下列四种状态中,处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | vA=2 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
B | vA=2 mol·L-1·min-1 | vC=2 mol·L-1·min-1 |
C | vA=1 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
D | vA=1 mol·L-1·min-1 | vC=1.5 mol·L-1·min-1 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上联合生产碳酸氢钠和氯代烃的工艺流程如图所示,在生产NaHCO3的过程中完成乙烯氯化,下列叙述错误的是( )
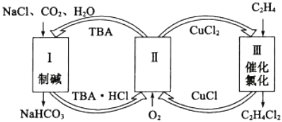
A.过程Ⅰ中的TBA替代了侯德榜制碱法中的氨气
B.在过程Ⅱ中实现了TBA、CuCl2的再生
C.过程Ⅲ中的反应方程式为C2H4+2CuCl2![]() C2H4C12+2CuC1
C2H4C12+2CuC1
D.理论上每生成1 mol NaHCO3,可得到1 mol C2H4C12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y和Z为原子序数依次增大的四种短周期元素。X是短周期原子半径最大的元素,Y的最高化合价与最低价相加为0,Z是同周期非金属性最强的元素,W、X、Y三种元素形成的一种化合物结构如图所示。下列叙述正确的是
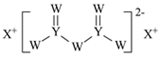
A.X单质的熔点高于Y单质
B.气态氢化物稳定性:Y<Z
C.Z的氧化物对应的水化物为强酸
D.X分别与W、Z形成的二元化合物溶于水显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关烷烃的叙述中,不正确的是( )
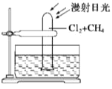
A.在烷烃分子中,所有的化学键都为单键
B.烷烃在光照条件下一般都能与Cl2发生取代反应
C.如图所示,将1体积甲烷和4体积Cl2充入试管中,
一段时间后,将看到水槽底部有油状液滴生成,试管内充满水
D.甲烷与Cl2在光照条件下发生反应的产物中,HCl在水槽中的浓度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类生活离不开化学,以下是补铁剂和胃药的两张标签的部分信息。
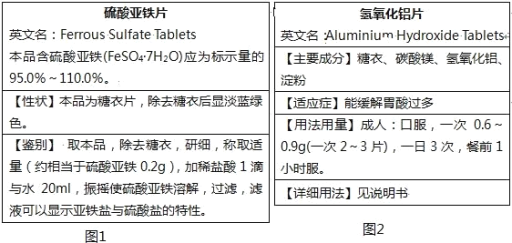
(1)根据“硫酸亚铁片”标签如图1回答:
①硫酸亚铁片中,糖衣的作用是_______;
②检验硫酸亚铁是否被氧化的试剂是_______;
③硫酸盐的鉴别反应的离子方程式是______;
④鉴别中,“加稀盐酸1滴”的作用是_______(选填序号);
A.防止亚铁离子被氧化 B.抑制亚铁离子水解
(2)根据氢氧化铝片标签如图2回答:
①能缓解胃酸过多的有效成分是______;
②写出氢氧化铝中和胃酸反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.某盐是一种重要的化工原料,在印染、制革、木材和农业等领域有重要用途,其溶液可能含有NH4+、Al3+、SO42-、Fe2+、Cl-等若干种离子,某同学设计并完成了如下实验:
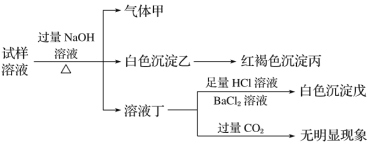
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中肯定有NH4+、SO42-和Fe2+
B.试样中一定没有Al3+
C.若气体甲在标准状况下体积为0.448 L,沉淀丙和沉淀戊分别为1.07 g和4.66 g,则可判断溶液中还有Cl-
D.该盐工业上可以用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不属于四种基本反应类型的氧化还原反应的是( )
A.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
B.2Na+Cl2![]() 2NaCl
2NaCl
C.Fe+CuSO4=Cu+FeSO4
D.Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如图所示:

下列描述正确的是( )
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)-1
B. 反应开始到l0s,X的物质的量浓度减少了0.79mol/L
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com