
【题目】一定质量的铁铝合金完全溶于过量的稀硝酸中,反应过程中共产生4.48 LNO(标准状况下测定),若在反应后的溶液中加入足量的氢氧化物溶液,则生成沉淀的质量不可能是
A.21.4 gB.18.7 gC.15.6 gD.7.8 g
【答案】A
【解析】
一定质量的铁铝合金完全溶于过量的稀硝酸,Fe、Al反应生成Fe(NO3)3、Al(NO3)3,HNO3获得电子变为NO,金属失去电子的物质的量与硝酸变为NO得到电子的物质的量相等。向反应后的溶液中加入足量的氢氧化钠溶液,Fe3+生成的沉淀为Fe(OH)3,Al3+变为AlO2-,最终没有沉淀生成,用讨论方法及极值方法分析计算沉淀的最大质量及沉淀质量范围。
标况下4.48 L NO的物质的量n(NO)=![]() =
=![]() =0.2 mol,Fe、Al反应生成Fe(NO3)3、Al(NO3)3,金属都为+3价,根据电子转移守恒,可知金属的总物质的量n(Fe+Al)=
=0.2 mol,Fe、Al反应生成Fe(NO3)3、Al(NO3)3,金属都为+3价,根据电子转移守恒,可知金属的总物质的量n(Fe+Al)=![]() =0.2 mol,向反应后的溶液中加入足量的氢氧化钠溶液,Fe3+生成的沉淀为Fe(OH)3,由于Al(OH)3是两性氢氧化物,能够与过量NaOH溶液反应,所以Al3+变为AlO2-,最终没有沉淀生成。假设金属全为Fe,最终得到沉淀质量增大,根据Fe原子守恒,可知生成0.2 mol Fe(OH)3,生成的Fe(OH)3的质量为:0.2 mol×107 g/mol=21.4g,若全为Al,则最后无沉淀生成,故金属为Al、Fe的混合物发生上述反应,最后沉淀的质量范围为:0g<m(沉淀)<21.4g,合理选项是A。
=0.2 mol,向反应后的溶液中加入足量的氢氧化钠溶液,Fe3+生成的沉淀为Fe(OH)3,由于Al(OH)3是两性氢氧化物,能够与过量NaOH溶液反应,所以Al3+变为AlO2-,最终没有沉淀生成。假设金属全为Fe,最终得到沉淀质量增大,根据Fe原子守恒,可知生成0.2 mol Fe(OH)3,生成的Fe(OH)3的质量为:0.2 mol×107 g/mol=21.4g,若全为Al,则最后无沉淀生成,故金属为Al、Fe的混合物发生上述反应,最后沉淀的质量范围为:0g<m(沉淀)<21.4g,合理选项是A。


科目:高中化学 来源: 题型:
【题目】化学反应4A(s) + 3B(g)![]() 2C(g) + D(g),经2min,B的浓度减小了0.6mol/L,对此反应速率的表示正确的是( )
2C(g) + D(g),经2min,B的浓度减小了0.6mol/L,对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4mol/(L·min)
B.升高温度,正反应速率增大,逆反应速率减小
C.2min末的反应速率用B表示为0.3 mol/(L·min)
D.用v(B)、v(C)表示B、C的反应速率:则3 v(C) = 2 v(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 H2CO3 ![]() HCO3-+H+ K1=4.3×10-7 HCO3
HCO3-+H+ K1=4.3×10-7 HCO3 ![]() CO32-+H+ K2=5.6×10-11
CO32-+H+ K2=5.6×10-11
HClO ![]() ClO-+H+ K=3.0×10-8
ClO-+H+ K=3.0×10-8
H2SO3 ![]() HSO3-+H+ K1=1.54×10-2 HSO3-
HSO3-+H+ K1=1.54×10-2 HSO3- ![]() SO32-+H+ K2=1.02×10-11
SO32-+H+ K2=1.02×10-11
根据电离平衡常数分析,下列各式中正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO=CO32-+2HClO
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO═CaSO3↓+2HClO
C.空气中CO2和水蒸气与Ca(ClO)2溶液反应:Ca2++2ClO+CO2+H2O═CaCO3↓+2HClO
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-═CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下图所示:

关于咖啡鞣酸的下列叙述正确的是( )
A.分子式为C16H13O9
B.1 mol咖啡鞣酸可与含8 mol NaOH的溶液反应
C.能使酸性KMnO4溶液褪色,说明分子结构中含有碳碳双键
D.与浓溴水能发生两种类型的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知pOH= -lgc(OH-),在T℃下,水溶液中pH与pOH的关系如图中直线所示。下列说法正确的是

A.T℃下水的离子积为10-14
B.若P点对应的温度为T1,则T1>T
C.T℃,pH=3溶液中,由水电离产生的c(H+)一定为1.0×10-10mol·L-1
D.T℃时,pH=4的盐酸与pOH=4氨水等体积混合后溶液pH>6.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列电化学装置的说法中正确的是

A.图a是原电池装置,可以实现化学能转化为电能
B.图b电解一段时间后,加入适量CuCO3固体,可以使硫酸铜溶液恢复到原浓度
C.图c中的X极若为负极,则该装置可实现粗铜的精炼
D.图d装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时AgBr在水中的沉淀溶解平衡曲线如图所示。t℃时AgCl的Ksp=4×10-10,下列说法不正确的是

A.在t℃时,AgBr 的 Ksp为4.9×10-13
B.在 t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数 K≈816
AgBr(s)+Cl-(aq)的平衡常数 K≈816
C.图中a点对应的是AgBr的不饱和溶液
D.在 AgBr 饱和溶液中加入NaBr固体,可使溶液由c点变到b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
![]() 已知:
已知:![]() 、
、![]() 分子中化学键的键能分别是
分子中化学键的键能分别是![]() 、
、![]()
![]()
![]()
则相同条件下破坏1molNO中化学键需要吸收的能量为______kJ。
![]() 如图所示,U形管内盛有100mL的溶液,
如图所示,U形管内盛有100mL的溶液,
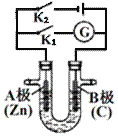
![]() 断开
断开![]() ,闭合
,闭合![]() ,若所盛溶液为
,若所盛溶液为![]() 溶液:则A为______极。若所盛溶液为KCl溶液:
溶液:则A为______极。若所盛溶液为KCl溶液:![]() 移向______极
移向______极![]() 填“A”、“B”
填“A”、“B”![]()
![]() 断开
断开![]() ,闭合
,闭合![]() ,若所盛溶液为滴有酚酞的NaCl溶液,则:A电极附近可观察到的现象是______。反应一段时间后打开
,若所盛溶液为滴有酚酞的NaCl溶液,则:A电极附近可观察到的现象是______。反应一段时间后打开![]() ,若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的______。
,若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的______。
![]() 若是电解精炼粗铜,断开
若是电解精炼粗铜,断开![]() ,闭合
,闭合![]() ,电解液选用
,电解液选用![]() 溶液,则A电极的材料应换成______,反应一段时间后电解质溶液中
溶液,则A电极的材料应换成______,反应一段时间后电解质溶液中![]() 浓度______
浓度______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com