
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO47H2O的流程如下: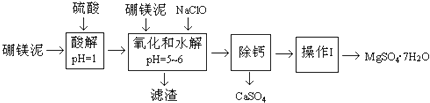
根据题意回答问题:
(1)实验中需用1mol/L的硫酸800mL,若用98%的浓硫酸(ρ=1.84g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为
A.10mL
B.20mL
C.50mL
D.100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO﹣+H2O→MnO2↓+2H++Cl﹣ , 还有一种离子也会被NaClO氧化,该反应的离子方程式为 .
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有 .
(4)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法 .
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤 . “操作I”是将滤液继续蒸发浓缩,冷却结晶, , 便得到了MgSO47H2O.
(6)实验中提供的硼镁泥共100g,得到的MgSO47H2O为172.2g,则MgSO47H2O的产率为 .
【答案】
(1)C
(2)2Fe2++ClO﹣+2H+═2Fe3++Cl﹣+H2O
(3)MnO2 , SiO2
(4)取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+
(5)蒸发浓缩,趁热过滤;过滤(或过滤洗涤)
(6)70%
【解析】解:(1)浓硫酸的物质的量浓度C= ![]() =
= ![]() mol/L=18.4mol/L,设浓硫酸的体积为V,18.4mol/L×V=1.0mol/L×0.8L,V=0.0435L=43.5mL,
mol/L=18.4mol/L,设浓硫酸的体积为V,18.4mol/L×V=1.0mol/L×0.8L,V=0.0435L=43.5mL,
所以答案是:C;(2)由于溶液中有亚铁离子,能够被次氯酸钠氧化成铁离子,反应的离子方程式为:2Fe2++ClO﹣+2H+═2Fe3++Cl﹣+H2O,所以答案是:2Fe2++ClO﹣+2H+═2Fe3++Cl﹣+H2O;(3)由于二氧化锰和二氧化硅不与稀硫酸反应,所以在滤渣中存在,所以答案是:MnO2 , SiO2;(4)可以向溶液中加入硫氰化钾溶液检验溶液中是否存在三价铁离子,方法为:取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+ , 所以答案是:取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+;(5)有温度对硫酸镁、硫酸钙的溶解度影响,温度越高,硫酸钙溶解度越小,可以采用蒸发浓缩,趁热过滤方法除去硫酸钙;操作I”是将滤液继续蒸发浓缩,冷却结晶,再经过过滤,便得到了MgSO47H2O,所以答案是:蒸发浓缩,趁热过滤;过滤(或过滤洗涤);(6)100g硼镁泥中氧化镁的物质的量为: ![]() =1mol,根据镁原子守恒,生成MgSO47H2O的物质的量为1mol,质量为246g/mol×1mol=246g,MgSO47H2O的产率为:
=1mol,根据镁原子守恒,生成MgSO47H2O的物质的量为1mol,质量为246g/mol×1mol=246g,MgSO47H2O的产率为: ![]() ×100%=70%,所以答案是:70%.
×100%=70%,所以答案是:70%.


科目:高中化学 来源: 题型:
【题目】足量铁粉与一定量的盐酸反应,为了减慢反应速率,但不减少氢气的产量,可加入下列物质中的( )
A.水
B.NaOH固体
C.Na2CO3固体
D.NaNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X+Y→M+N为放热反应,下列说法正确的是( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因为该反应是放热反应,故不必加热反应一定发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某溶液由水电离出的c(OH﹣)=1.0×10﹣13mol/L.对该溶液叙述正确的是( )
A.溶液一定显酸性
B.溶液一定显碱性
C.溶液一定不显中性
D.溶液可能显酸性.也可能显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式表达正确的是
A. Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B. 钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
C. 向铜片中滴加浓硫酸并加热:Cu+4H++SO42-![]() Cu2++SO2↑+2H2O
Cu2++SO2↑+2H2O
D. 将10mL2mol/LNH4Fe(SO4)2溶液与10mL3mol/L的Ba(OH)2溶液:2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的浓度关于不正确的是( )
A.NaClO溶液中:c(Na+)=c(HClO)+c(ClO﹣)
B.等体积、等物质的量浓度的NaX和弱酸HX混合,所得溶液中:c(Na+)>c(X﹣)>c(H+)>c(OH﹣)
C.将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(NH ![]() )>c(Cl﹣)>c(NH3?H2O)>c(OH﹣)>c(H+)
)>c(Cl﹣)>c(NH3?H2O)>c(OH﹣)>c(H+)
D.将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(Na+)+c(H+)=2c(S2﹣)+c(HS﹣)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+Cl2(s)2HCl(g)△H=+akJ/mol H2(g)+Cl2(g)2HCl(g)△H=﹣dkJ/mol ![]() 且a、b、c、d均大于零,则下列说法正确的是( )
且a、b、c、d均大于零,则下列说法正确的是( )
A.断开1molH﹣Cl键所需的能量为﹣a﹣b﹣c
B.b>c,则氢气分子具有的能量高于氯气分子具有的能量
C.Cl2(s)=Cl2(g)△H=+(a+d)kJmol﹣1
D.向1molCl2(g)中通入1molH2(g),发生反应时放热dkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于分散系,下列叙述中正确的是
A. 直径介于1nm~100nm之间的微粒称为胶体
B. 电泳现象可证明胶体带电荷
C. 利用丁达尔效应可以区别溶液与胶体
D. 按照分散质和分散剂状态不同(固、液、气),它们之间可有6种组合方式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com