
����Ŀ���Ĵ���֦���̲طḻ�ķ����ѡ�����Դ����������������Ҫ�ɷ�ΪTiO2��FeO��Fe2O3��Ti������ϼ�Ϊ+4����ԭ�ϣ�������ɫ���϶������ѵ���Ҫ�������£�
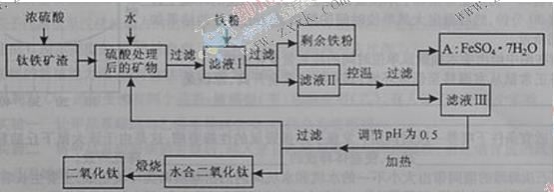
��ش��������⣺
��1��������������ѷ�Ӧ�Ļ�ѧ����ʽ��____________________________________��
��2������ҺI�м������ۣ�������Ӧ�����ӷ���ʽΪ��_________________________��_______________________________________��
��3����ʵ�����������У����ˮ�м�����Һ��ʹ���ҺpH��0.5�����ο�ʼˮ�⡣ˮ������в���ͨ�����ˮ������ά����Һ����һ��ʱ�䣬���γ��ˮ������ˮ�϶������ѳ�����������ѧ��ѧƽ��ԭ������ͨ�����ˮ���������ã�_______________________________________________��
���˷����ˮ�϶������ѳ�������Һ���ص���ҪĿ���dz��������Һ�е����Ρ�___________��______________��_______________________���ѧʽ�������ٷ����ŷš�
��4��A������������ɫ���ϣ�Fe2O3�����䷽���ǣ���556a kg A��Ħ������Ϊ278 g/mol������ˮ�У�������������������Һǡ����ȫ��Ӧ�����������������裬�������ɫ���壻������ɫ�����м���3336b kg A��112c kg���ۣ����������������裬��Ӧ��ɺ��д���Fe2O3�����ڽ����������Գ�����ʽ���������˺������������յú�ɫ���ϡ���������Һ������ֻ�������ƺ����������������Ͽ�������ɫ����_______________________kg��
���𰸡�![]() ��
��![]()
![]()
![]() ��ˮ�ٽ�����ˮ�⣬���ȴٽ�����ˮ�⣬����
��ˮ�ٽ�����ˮ�⣬���ȴٽ�����ˮ�⣬����![]() Ũ�ȴٽ�����ˮ��
Ũ�ȴٽ�����ˮ�� ![]()
![]()
![]()
![]()
��������
������������Ҫ�ɷ�ΪTiO2��FeO��Fe2O3������Ũ���ᣬTiO2��FeO��Fe2O3��Ũ���ᷴӦ�����������Σ���ˮ�����Һ������Ҫ��Ti(SO4)2��FeSO4��Fe2(SO4)3������������ۿɺ�Fe2(SO4)3��Ӧ����FeSO4���ٹ��ˣ��õ�����Һ���е�FeSO4����ͨ������Ũ������ȴ�ᾧ��FeSO4��7H2O��ʽ��������Һ�������Һ��pH��ʹ������ˮ��õ�ˮ�϶������ѣ����յõ��������ѡ�
��1��������������ѷ������ֽⷴӦ����ѧ����ʽ��![]() ��
��
��2������ҺI�м������ۣ���ҺI�е�H+��Fe3+�����Ժ���������Ӧ�����ӷ���ʽΪ��![]() ��
��![]() ��
��
��3��ˮ�������ȵģ�����ˮ����ʹˮ��ƽ�������ƶ���������ˮ������в���ͨ�����ˮ���������γ��ˮ������ˮ�϶������ѳ��������˷����ˮ�϶������ѳ�������Һ�е����Ρ�H2O��FeSO4��H2SO4������ѭ�����á��ʴ�Ϊ����ˮ�ٽ�����ˮ�⣬���ȴٽ�����ˮ�⣬����![]() Ũ�ȴٽ�����ˮ�⣬H2O��FeSO4��H2SO4��
Ũ�ȴٽ�����ˮ�⣬H2O��FeSO4��H2SO4��
��4��556a kg FeSO4��7H2O�����ʵ���Ϊ2a��103mol����������������Һǡ����ȫ��Ӧ�����Լ����NaOH�����ʵ���4a��103mol���������ɫ����Fe(OH)3���ټ���3336b kg FeSO4��7H2O(12b��103mol)��112c kg(2c��103mol)���ۡ�������Һ������ֻ�������ƺ���������Na+Ϊ4a��103mol��SO42-Ϊ4a��103mol+12b��103mol�����ݵ���غ㣬��Һ�е�Fe3+Ϊ8b��103mol����Fe2O3�е�����2a��103mol+(12b��103mol -8b��103mol)+2c��103mol������Fe2O3�����ʵ���Ϊa��103mol+2b��103mol+c��103mol��Fe2O3������Ϊ160(a��103mol+2b��103mol+c��103mol)g=![]() kg��
kg��


 ������ϵ�д�
������ϵ�д� �±�Сѧ��Ԫ�Բ���ϵ�д�
�±�Сѧ��Ԫ�Բ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��С�ձ�����һ��մ��ˮ�IJ���Ƭ�ϣ������Ȼ�粒�����������������[Ba��OH��28H2O��]�����ò��������裬����Ƭ�ϵ�ˮ����˱����ɴ˿�֪��������
A.�÷�Ӧ�У���ѧ��ת�������
B.��Ӧ��������������������������
C.�Ȼ�������������ķ�ӦΪ���ȷ�Ӧ
D.��Ӧ���Ȼ�ѧ����ʽΪ 2NH4Cl+Ba��OH��2��BaCl2+2NH3H2O��Q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ת����ϵ���ش����⣺

��֪������CH3Br![]() CH3��HBr��
CH3��HBr��
��C���ʱ�����һ±����ֻ�����֡�
(1)д��B���ʵ�����__________��D���ʵĽṹ��ʽ________��
(2)д����Ӧ��������________����Ӧ��������________��
(3)д����Ӧ���Ļ�ѧ����ʽ��________________________________��
(4)д��D��E��Ӧ�Ļ�ѧ����ʽ��_______________��
(5)��Ӧ�����п�������һ��C16H18���л���䱽����һ±����Ҳֻ�����֣�д�����Ľṹ��ʽ��_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ƣ�Na2S2O5���dz��õ�ʳƷ��������֮һ��ij�о�С���������ʵ�飺
ʵ��һ ���������Ƶ���ȡ
������ͼװ��(ʵ��ǰ�ѳ���װ���ڵĿ���)��ȡNa2S2O5��װ�â�����Na2S2O5���������������ķ�ӦΪ��Na2SO3��SO2��Na2S2O5

��1��װ��I�в�������Ļ�ѧ����ʽΪ__________________��
��2��Ҫ��װ�â��л���������ľ��壬�ɲ�ȡ�ķ��뷽����_________��
��3��װ�â����ڴ���β������ѡ�õ������װ��(�г���������ȥ)Ϊ________(�����)��

ʵ��� ���������Ƶ�����
Na2S2O5����ˮ������NaHSO3��
��4��֤��NaHSO3��Һ��HSO3���ĵ���̶ȴ���ˮ��̶ȣ��ɲ��õ�ʵ�鷽����________(�����)��
a���ⶨ��Һ��pH b������Ba(OH)2��Һ c����������
d������Ʒ����Һ e������ɫʯ����ֽ���
��5������Na2S2O5�����ڿ������ѱ�������ʵ�鷽����____________��
ʵ���� ���Ѿ��п��������������IJⶨ
��6�����ѾƳ���Na2S2O5�������������ⶨij���Ѿ��п��������IJ�����(������SO2����)�ķ������£�

(��֪���ζ�ʱ��Ӧ�Ļ�ѧ����ʽΪSO2��I2��2H2O��H2SO4��2HI)
�ٰ���������ʵ�飬���ı�I2��Һ25.00 mL���ô�ʵ������Ʒ�п��������IJ�����(������SO2����)Ϊ________________g��L��1��
��������ʵ������У����в���HI���������������ý��____(�ƫ�ߡ���ƫ�͡����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ���л���ѧ������
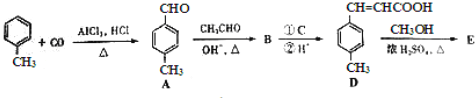
3���Լױ���ϩ�������E����һ�����ںϳɿ�Ѫ˨ҩ���м��壬��ϳ�·�����£�
��֪��HCHO+CH3CHO![]() CH2=CHCHO+H2O
CH2=CHCHO+H2O
��1����FeCl3��Һ����ɫ�ұ�����������ȡ������A��ͬ���칹����___________�֣�B�к��������ŵ�����Ϊ___________��
��2���Լ�C��ѡ�������е�___________��
a����ˮ
b��������Һ
c������KMnO4��Һ
d������Cu(OH)2����Һ
��3��![]() ��E��һ��ͬ���칹�壬������������NaOH��Һ���ȵĻ�ѧ����ʽΪ___________��
��E��һ��ͬ���칹�壬������������NaOH��Һ���ȵĻ�ѧ����ʽΪ___________��
��4��E��һ�������¿������ɸ߾���F��F�Ľṹ��ʽΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к��е����ӿ�����K+��Ba2+��Al3+��Mg2+��A1O2-��CO32-��SiO32-��Cl-�еļ��֣��ֽ�������ʵ�飺
��ȡ������Һ������������Һ�������������ɣ�
����ȡ����ԭ��Һ����μ���5 mL 0.2 mol L-1�����ᣬ�����������ǿ�ʼ���������������࣬���������������������壬��������������ʧ��
���������ڳ�����ʧ�����Һ�У��ټ�����������������Һ�ɵõ�����0.435 g��
����˵������ȷ����
A.����Һ��һ��������Ba2+��Mg2+��Al3+��SiO32-��Cl-
B.����Һ��һ������K+��AlO2-��CO32-��Cl-
C.����Һ���Ƿ���K+������ɫ��Ӧ������ɫ�ܲ���Ƭ��
D.���ܺ���Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ۺ�ij����������(xFeO��yFe2O3)��ĩ������ȼ����ֳ����ȷݡ�һ���ڸ�����ǡ����ȫ��Ӧ�������������ᷴӦ����һ��ֱ�ӷ����������ռ���Һ�г�ַ�Ӧ��ǰ��������������ɵ�������������5 : 7����x : yΪ
A.1��1B.1��2C.5��7D.7��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ����ʽ��д��ȷ����
A.CH4 + Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B.CH2=CH2 + Br2![]() CH3CHBr2
CH3CHBr2
C.2CH3CH2OH + O2![]() 2CH3CHO +2H2O
2CH3CHO +2H2O
D.CH3COOH+CH3CH2OH![]() CH3COOHCH2CH3+H2O
CH3COOHCH2CH3+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����~��Ԫ�������ڱ��е����λ����ͼ�������γɻ�������������Ԫ�أ��ұȼ�ԭ��������6�������졢����ͬ����Ԫ�أ������жϴ������

A.�ҵĵ����ڿ�����ȼ�����ɵĻ�����ֻ�����Ӽ�
B.������λ�ڽ�����ǽ��������߸���
C.�����Ѻ�����������12
D.��ͼ��ǹ���Ԫ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com