
【题目】2014年5月7日,天津某工程检测公司在进行探伤作业期间,一枚黄豆粒大小的放射源铱-192丢失,造成了严重的安全事故,图示是铱在元素周期表中的信息,下列说法正确的是( )
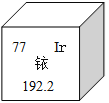
A. 铱的相对原子质量为192.2克
B. 铱原子核内的中子数为77
C. K2IrO3中Ir的化合价为+4
D. 生活中常用的铱金笔为纯净的铱单质
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】铝热反应不仅用于焊接钢轨,而且还常用于冶炼熔点较高的金属如钒、铬、锰等。
请配平下列用铝热反应冶炼金属钒和钴的化学方程式,指出哪些物质是还原剂、哪些物质是氧化剂,并计算生成1 mol各种金属分别需要纯铝的质量。
V2O5+Al——Al2O3+V Co3O4+Al——Al2O3+Co
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属腐蚀与防护的说法不正确的是
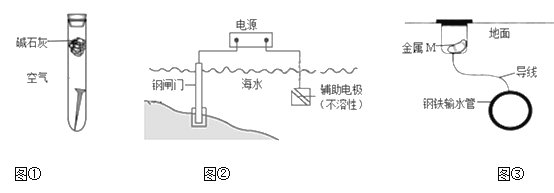
A. 图①,放置于干燥空气中的铁钉不易生锈
B. 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
C. 图②,若断开电源,钢闸门将发生吸氧腐蚀
D. 图③,若金属M比Fe活泼,可防止输水管腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |

(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
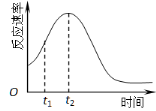 (5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:

① ;② 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的位置如右图所示, B、C两元素的原子序数之和是A元素原子序数的4倍,各元素对应的物质相互比较,其中关系正确的是

A.原子半径:C>D>AB.单质的熔点:B>C,D>A
C.最高正价:B>D=A>CD.气态氢化物的稳定性:B>C,D>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按如图所示要求,完成下列实验:
实验①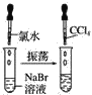
实验②
实验③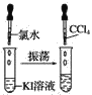
(1)实验①静置后,观察到实验现象是__,反应的化学方程式是__。
(2)实验②静置后,观察到实验现象是__,反应的化学方程式是__。
(3)实验③静置后,观察到实验现象是__,反应的化学方程式是__。
(4)通过上述实验可知,卤素单质氧化性由强到弱的顺序是__,卤素阴离子的还原性由强到弱的顺序是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)铅蓄电池是典型的二次电池,电池总反应式为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________________________。当外电路通过1 mol电子时,理论上负极板的质量增加______g。
2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________________________。当外电路通过1 mol电子时,理论上负极板的质量增加______g。
(二)某研究性学习小组,为了探究电极与原电池的电解质之间关系,设计了下列实验方案:用铝片、铜片、镁片作电极,分别与下列溶液构成原电池,并接电流表。
(1)若用HNO3(浓)作电解质溶液,电极为铜片和铝片,正极上发生的电极反应式为________________;
(2)若电解质溶液为0.5mol/LNaOH溶液,电极为镁片和铝片,则负极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中各组物质不能实现如图所示转化的是
![]()
选项 | 甲 | 乙 | 丙 |
A | CO2 | NaHCO3 | Na2CO3 |
B | AlCl3 | Al2O3 | NaAlO2 |
C | AlCl3 | Al | Al(OH)3 |
D | AlCl3 | Al(OH)3 | NaAlO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。![]() 、
、![]() 常用作锂离子电池的正极材料,请回答下列问题:
常用作锂离子电池的正极材料,请回答下列问题:
(1)基态锂原子的最高能级的电子云形状是________;基态磷原子有________个未成对电子;基态铁原子核外电子排布式为________。
(2)![]() 中
中![]() 的配位数为4,配体中N的杂化方式为________,该配离子中各元素的第一电离能由小到大的顺序为________(用元素符号表示)。
的配位数为4,配体中N的杂化方式为________,该配离子中各元素的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)![]() 在水中易被还原成
在水中易被还原成![]() ,而在氨水中可稳定存在,其原因为________。
,而在氨水中可稳定存在,其原因为________。
(4)![]() 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:

这类磷酸根离子的化学式可用通式表示为________(用n代表P原子数)。
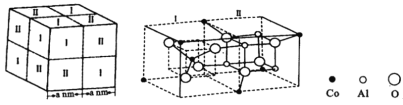
(5)钴蓝晶体结构如下图,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成。晶体中![]() 占据
占据![]() 形成的________(填“四面体空隙”或“八面体空隙”);钴蓝晶体的密度为___________
形成的________(填“四面体空隙”或“八面体空隙”);钴蓝晶体的密度为___________![]() (列出计算式,用
(列出计算式,用![]() 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com