
| 2×12 |
| 85.7% |
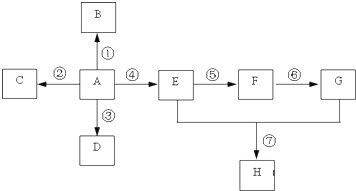
 ,D为烃,且不能使酸性高锰酸钾溶液褪色,则乙烯与氢气发生加成反应生成D为C2H6,E、G为生活中常见的有机物,且E有特殊香味,则E为CH3CH2OH,G为CH3COOH,乙烯与水发生加成反应生成乙醇,乙醇发生氧化反应生成F为CH3CHO,乙醛进一步氧化生成乙酸,乙酸与乙醇分子酯化反应生成H为CH3COOCH2CH3,C为无色无味气体,实验室中可以通过G与大理石制取,则C为CO2,故乙烯燃烧生成C,据此解答.
,D为烃,且不能使酸性高锰酸钾溶液褪色,则乙烯与氢气发生加成反应生成D为C2H6,E、G为生活中常见的有机物,且E有特殊香味,则E为CH3CH2OH,G为CH3COOH,乙烯与水发生加成反应生成乙醇,乙醇发生氧化反应生成F为CH3CHO,乙醛进一步氧化生成乙酸,乙酸与乙醇分子酯化反应生成H为CH3COOCH2CH3,C为无色无味气体,实验室中可以通过G与大理石制取,则C为CO2,故乙烯燃烧生成C,据此解答.| 2×12 |
| 85.7% |
 ,D为烃,且不能使酸性高锰酸钾溶液褪色,则乙烯与氢气发生加成反应生成D为C2H6,E、G为生活中常见的有机物,且E有特殊香味,则E为CH3CH2OH,G为CH3COOH,乙烯与水发生加成反应生成乙醇,乙醇发生氧化反应生成F为CH3CHO,乙醛进一步氧化生成乙酸,乙酸与乙醇分子酯化反应生成H为CH3COOCH2CH3,C为无色无味气体,实验室中可以通过G与大理石制取,则C为CO2,故乙烯燃烧生成C,
,D为烃,且不能使酸性高锰酸钾溶液褪色,则乙烯与氢气发生加成反应生成D为C2H6,E、G为生活中常见的有机物,且E有特殊香味,则E为CH3CH2OH,G为CH3COOH,乙烯与水发生加成反应生成乙醇,乙醇发生氧化反应生成F为CH3CHO,乙醛进一步氧化生成乙酸,乙酸与乙醇分子酯化反应生成H为CH3COOCH2CH3,C为无色无味气体,实验室中可以通过G与大理石制取,则C为CO2,故乙烯燃烧生成C,| 一定条件 |
 ,
,| 一定条件 |
| 浓硫酸 |
| △ |
| 一定条件 |
 ;CH2=CH2+H2O
;CH2=CH2+H2O| 一定条件 |
| 浓硫酸 |
| △ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+184.6kJ?mol-1 |
| B、-92.3kJ?mol-1 |
| C、-369.2kJ?mol-1 |
| D、+92.3kJ?mol- |
查看答案和解析>>
科目:高中化学 来源: 题型:
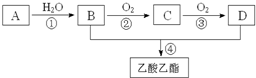 已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
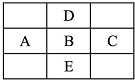 如图是周期表的一部分,A、B、C、D、E五种元素的原子核共含有80个质子.
如图是周期表的一部分,A、B、C、D、E五种元素的原子核共含有80个质子.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原固体混合中n[(NH4)2SO4]=0.05 mol |
| B、原固体混合中m(NH4NO3)=16 g |
| C、若完全溶解后溶液的体积为100 mL,则c(NH4NO3)=4 mol?L-1 |
| D、原固体混合中n(NH4NO3):n[(NH4)2SO4]=4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com