
【题目】某二元酸在水中的电离方程式为:H2B=H++HB-; HB-![]() H++B2-。回答下列问题:
H++B2-。回答下列问题:
(1)Na2B溶液显__________(填“酸性、中性、或碱性”),理由是(用离子方程式表示):____________________________________________。
(2)在0.1mol/L的Na2B溶液中,下列粒子浓度关系正确的是__________。
A.c(B2-)+c(HB–)+c(H2B)=0.1 mol/L
B.c(Na+)+ c(H+)= c(HB–)+c(OH–) +2c(B2-)
C.c(Na+)=2c(HB–) +2c(B2-)
D. c(H+)=c(OH–)-c(HB–)-2c(H2B)
(3)已知0.1 mol/LNaHB溶液的pH=2,则0.1 mol/LH2B溶液中c(H+)可能是_____0.11mol/L(填“<”、“>”或“=”),理由是_______________________。
(4)0.1mol/LNaHB溶液中各种离子浓度大小为_________________________。
【答案】 碱性 B2-+H2O![]() HB-+OH- BC < H2B第一步电离产生的H+,抑制了HB-的电离 c(Na+)>c(HB–) >c(H+)>c(B2–)>c(OH–)
HB-+OH- BC < H2B第一步电离产生的H+,抑制了HB-的电离 c(Na+)>c(HB–) >c(H+)>c(B2–)>c(OH–)
【解析】本题主要考查弱酸电离及盐类水解。
(1)Na2B溶液显碱性,理由是(用离子方程式表示)B2-+H2O![]() HB-+OH-。
HB-+OH-。
(2)A.溶液中不存在H2B,故A错误;B.电荷守恒:c(Na+)+ c(H+)= c(HB–)+c(OH–) +2c(B2-),故B正确;C.从Na2B的组成比可得c(Na+)=2c(HB–) +2c(B2-),故C正确;D. 溶液中不存在H2B,故D错误。故选BC。
(3)已知0.1 mol/LNaHB溶液的pH=2,则0.1 mol/LH2B溶液中c(H+)可能是<0.11mol/L,理由是H2B第一步电离产生的H+,抑制了HB-的电离。
(4)0.1mol/LNaHB溶液中pH=2表明HB-的电离程度大于水解程度,各种离子浓度大小为c(Na+)>c(HB–) >c(H+)>c(B2–)>c(OH–)。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1mol X(g)和2mol Y(g)发生反应:X(g)+mY(g) ![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A. m=2 B. 第二次平衡时,Z的浓度为0.4mol/L
C. X与Y的平衡转化率之比为1:1 D. 两次平衡的平衡常数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子的物质的量浓度大小关系正确的是( )
A. 等物质的量浓度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 ④(NH4)2CO3,其中c(CO32-)的大小关系为:②>④>③>①
B. pH=2 的H2C2O4溶液与pH=12 的NaOH 溶液等体积混合:c(H+)+c(Na+)=c(OH-)+c(HC2O4-)+c(C2O42-)
C. 向0.2mo/L 的NaHCO3 溶液中加入等体积0.1mo/L 的NaOH 溶液:c(CO32- )>c(HCO3-)>c(OH-)>c(H+)
D. 常温下,等浓度的CH3COOH与CH3COONa 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(H+)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质既不属于同系物,也不属于同分异构体的是( )
A. 邻氯甲苯和对氯甲苯 B. 一氯甲烷和二氯乙烷
C. 乙酸和硬脂酸 D. 蔗糖和麦芽糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.在25℃,1.01×105Pa时,11.2L氮气所含的原子数目为NA
B.48g O3 和O2混合气体所含的原子数目为3NA
C.1mol氦气所含的电子数目为4NA
D.2.7g金属铝变成铝离子时失去的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行以下可逆反应:M(g)+N(g)P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则该反应( ) 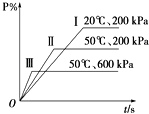
A.正反应放热,L是固体
B.正反应放热,L是气体
C.正反应吸热,L是气体
D.正反应放热,L是固体或气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用大理石和盐酸制备CO2。下列措施可使反应速率加快的是( )
A. 降低反应温度 B. 延长反应时间 C. 粉碎大理石 D. 加水稀释盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A、B、C、D是中学常见的混合物分离或提纯的基本装置.
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置.将A、B、C、D 填入适当的空格中.
(1)分离植物油和水;
(2)除去粗盐中的泥沙;
(3)与海水晒盐原理相似的是;
(4)用四氯化碳碘水中提取碘;
(5)分离CCl4(沸点:76.75℃)和甲苯(沸点:110.6℃)的混合物 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将有铜的印刷线路板浸入120mL氯化铁浓溶液中,有9.6g铜被腐蚀掉.取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶解的物质.(设溶液体积不变,且不考虑金属离子水解).请回答下列问题:
(1)充分反应后,溶液中存在4.8g不溶物的成分为(用化学式表示).
(2)充分反应后溶液中一定不存在的金属离子为 .
(3)比较Fe2+、Fe3+、Cu2+的氧化性大小: .
(4)试计算最后溶液中Fe2+离子的物质的量浓度mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com