
解析:(1)利用“N”守恒可知需m(NaN3)= ×
×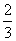 ×65 g·mol-1=78 g。
×65 g·mol-1=78 g。
(2)①由反应方程式可知产生1 mol H2同时生产2 mol OH-,故c(OH-)=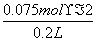 =0.75 mol/L;②设合金中Na、K的物质的量分别为a mol、b mol,然后利用质量守恒与得失电子守恒可得方程式:a+b=0.75×2和23a+39b=5.05,解得a=0.050 mol、b=0.10 mol,故可得到合金的化学式为NaK2。
=0.75 mol/L;②设合金中Na、K的物质的量分别为a mol、b mol,然后利用质量守恒与得失电子守恒可得方程式:a+b=0.75×2和23a+39b=5.05,解得a=0.050 mol、b=0.10 mol,故可得到合金的化学式为NaK2。
(3)若溶液仅含NaAl(OH)4,利用方程式可知得到24 mol Al(OH)3的同时生成12 mol Na2CO3,而实际得到24 mol Al(OH)3 与15 mol Na2CO3,说明溶液中含有NaOH,且NaOH优先与CO2反应生成Na2CO3,利用Na守恒知溶液中n(NaOH)=(15-12) mol×2=6 mol,故通入 112 L (5 mol)CO2先与NaOH作用消耗3 mol CO2生成3 mol Na2CO3,然后2 mol CO2与NaAl(OH)4作用得到4 mol Al(OH)3和2 mol Na2CO3,故n[Al(OH)3]∶n(Na2CO3)=4∶(3+2)=4∶5。
(4)由NaOH+HCl===NaCl+H2O可知溶液pH=7时,二者恰好反应完全,故三次实验得到的固体均为纯净氯化钠,利用“钠守恒”得 =
=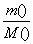 ,利用该式和题中数据可计算出三次实验中所取氢氧化钠样品的摩尔质量,进而可得出结论。
,利用该式和题中数据可计算出三次实验中所取氢氧化钠样品的摩尔质量,进而可得出结论。
答案:(1)78 (2)①c(OH-)=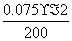 ×1 000=0.75 (mol/L)
×1 000=0.75 (mol/L)
②设上述合金中含a mol钠、b mol钾,则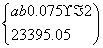
a=0.050 b=0.10
该钠—钾合金的化学式为NaK2。
(3)溶液含氢氧化钠。氢氧化钠和二氧化碳反应生成碳酸钠:15-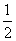 ×24=3 (mol)
×24=3 (mol)
112 L二氧化碳的物质的量: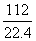 =5 (mol)
=5 (mol)
n[Al(OH)3]∶(Na2CO3)=[(5-3)×2]∶5=4∶5
(4)由氯化钠的质量推算,氢氧化钠样品的摩尔质量为
M1(氢氧化钠)= ×2.40=40 (g/mol)
×2.40=40 (g/mol)
M2(氢氧化钠)=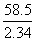 ×2.32=58 (g/mol)
×2.32=58 (g/mol)
M3(氢氧化钠)= ×3.48=58 (g/mol)
×3.48=58 (g/mol)
结论:
实验①所取氢氧化钠样品是NaOH;
实验②和实验③所取氢氧化钠样品应该是NaOH·H2O。
两个学习小组用下图装置探究乙二酸(HOOC—COOH)受热分解的部分产物
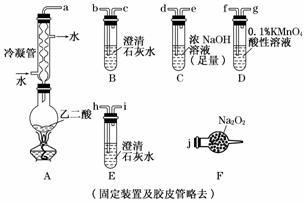
(1)甲组:
①按接口顺序a-b-c-d-e-f-g-h连接装置进行实验,B中溶液变浑浊,证明分解产物有________;装置C的作用是________;E中溶液变浑浊,D中的现象是________,证明分解产物有________.
②乙二酸受热分解的化学方程式为____________________________________________.
(2)乙组:
①将接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,则F中最主要反应的化学方程式为_______________________________________________________.
②从A~F中选用装置进行实验,证明甲组通入D的气体能否与Na2O2反应.最简单的装置接口连接顺序是____________;实验后用F中的固体进行验证的方法是__________(可另选试剂).
解析:(1)E中溶液变浑浊,只能是产生了CO2,但乙二酸分解产生的CO2已被C中的NaOH溶液完全除去,所以CO2只能是由CO和KMnO4(H+)溶液反应所得.
(2)通入D的气体CO2与Na2O2若能反应,产物只能为Na2CO3.检验Na2CO3,先加酸看产生的气体能否使澄清石灰水变浑浊来检验.
答案:(1)①CO2 充分除去CO2 溶液褪色或变浅 CO
②HOOC—COOH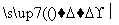 CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
(2)①2Na2O2+2CO2===2Na2CO3+O2
②a-d-e-j 取F中的固体,滴加稀硫酸,将生成的气体通入澄清石灰水中,若变浑浊,则发生了反应;若不变浑浊,则未发生反应


科目:高中化学 来源: 题型:
图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。
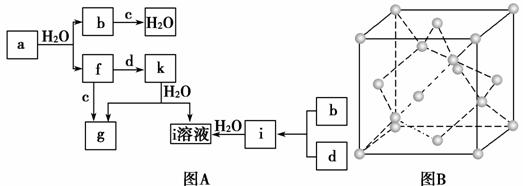
回答下列问题:
(1)图B对应的物质名称是________,其晶胞中的原子数为________,晶体类型为________。
(2)d中元素的原子核外电子排布式为________________________________________。
(3)图A中由二种元素组成的物质中,沸点最高的是________,原因是____________________,该物质的分子构型为________,中心原子的杂化轨道类型为________。
(4)图A中的双原子分子中,极性最大的分子是____________________________________。
(5)k的分子式为________,中心原子的杂化轨道类型为________,属于________分子(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
称取粗盐

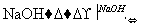
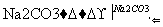
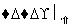 滤液
滤液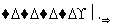
 精盐
精盐
(1)判断BaCl2已过量的方法是____________________________________________
_______________________________________________________________________。
(2)第④步中,相关的化学方程式是______________________________________
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年4月13日,上海市质量技术监督局曝光了“染色”馒头事件,“染色”馒头主要掺有违禁添加剂“柠檬黄”,过量食用对人体会造成很大危害。柠檬黄生产原料主要是对氨基苯磺酸及酒石酸,其结构简式如下图,则下列有关说法正确的是( )
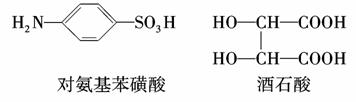
A.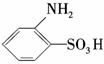 用习惯命名法可命名为邻氨基苯磺酸
用习惯命名法可命名为邻氨基苯磺酸
B.对氨基苯磺酸、酒石酸都能发生加成反应和取代反应
C.对氨基苯磺酸、酒石酸的核磁共振氢谱中都有三种峰
D.1 mol酒石酸分别和足量钠、碳酸氢钠反应,都能产生2 mol气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氯的说法正确的是( )
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B. Cl、
Cl、 Cl为不同的核素,有不同的化学性质
Cl为不同的核素,有不同的化学性质
C.实验室制备Cl2可用排饱和食盐水集气法收集
D.1.12 L Cl2含有1.7NA个质子(NA表示阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中含有原子数由多到少排列正确的是( )
①0.1molH2SO4 ②4.8g氦气 ③5.6L标况下NH3(气)④4℃时的5.4mLH2O
A.①②③④ B.④③②① C.②③④① D.②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中需要220mL0.5mol/L H2SO4,现用98%浓硫酸(密度为1.84g/cm3)稀释配制。
(1)本实验室中需要的仪器是 。
(2)要将浓硫酸在 中稀释,稀释时的操作方法是 。
(3)必须将稀释后的硫酸 后再移液,原因是 ,否则,所配制的稀硫酸浓度会 (偏高、偏低、无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
与淀粉相关的物质间转化关系如下图所示。其中B的分子中含有一个甲基,B与羧酸和醇均能发生酯化反应;C的催化氧化产物既是合成酚醛树脂的原料之一,又是常见的居室污染物;E能使Br2的CCl4溶液褪色。


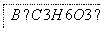





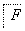
(1)B的结构简式是________。
(2)E―→F的化学方程式是_________________________ _______________________。
_______________________。
(3)某同学欲验证淀粉完全水解的产物A,进行如下实验操作:①在试管中加入少量淀粉溶液 ②加热3~4 min ③加入少量新制的Cu(OH)2悬浊液 ④加入少量稀硫酸 ⑤加热 ⑥待冷却后,滴加NaOH溶液至溶液呈碱性。则以上操作步骤正确的顺序是(填选项序号)________。
a.①②④⑤③⑥ b.①④②③⑤⑥
c.①④②⑥③⑤ d.①⑤③④⑥②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com