
【题目】已知Na2SO3固体与硫酸可发生反应:Na2SO3+ H2SO4=Na2SO4+H2O+SO2↑,下图是实验室制取SO2并验证SO2的某些性质的装置图。回答正确的是( )

A. ①中的实验现象为紫色石蕊试液褪色此实验证明SO2具有漂白性
B. ③中溶液变浑浊是因为SO2和H2S发生了氧化还原反应,氧化产物和还原产物质量比为1∶1
C. ④和②中溶液均褪色,但褪色的原理不同
D. 实验室中可以用澄清石灰水代替氢氧化钠溶液
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】2017年5月18日,中国成为全球首个实现海域成功开采可燃冰的国家,可燃冰是一种甲烷的水合物,下列有关甲烷的说法正确的是
A. 分子式为CH4 B. 极易溶于水 C. 常温下不稳定 D. 是可再生能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在相应的条件下可能大量共存的是( )
A.能使pH试纸变红的溶液中:CO32﹣、K+、Cl﹣、Na+
B.![]() ═10﹣10mol/L的溶液中:Na+、HCO3﹣、Cl﹣、K+
═10﹣10mol/L的溶液中:Na+、HCO3﹣、Cl﹣、K+
C.在c(OH﹣)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl﹣、NO3﹣
D.由水电离产生的c(OH﹣)=1×10﹣12mol/L的溶液中:NO3﹣、Mg2+、Na+、SO42
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃1体积只能与1体积氯气发生加成反应,生成氯代烷烃,此氯代烷烃1mol可与4mol氯气发生完全的取代反应,则该烃的结构简式为( )
A.CH2═CH2
B.CH3CH═CH2
C.CH3CH3
D.CH2═CHCH═CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气在工业上有着重要的用途,某兴趣小组在实验室中模拟工业上用氯气制备无水氯化铝(无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾)。可用下列装置制备。

(1)装置B中盛放____溶液,C和F中装的是同一种试剂,该试剂为________________。
(2)装置A的圆底烧瓶中发生反应的化学方程式为_______________________________。
(3)实验步骤:如图连接装置后,先检验装置气密性,再装药品,然后点燃___________(填“A”或“C”)处酒精灯,当____(填实验现象)时,再点燃___________(填“A”或“C”)处酒精灯。
(4)装置G的作用是__________________,写出G中反应的离子方程式_____________________。
(5)甲同学认为装置D和E中间的细玻璃导管换成粗的玻璃导管为什么?___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生产生活中,我们会遇到各种各样的化学反应。请按要求回答下列问题:
(1)焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、N2、Fe2O3、Fe、FeCl3 和 X。
①根据题意,可判断出X是_____________(写化学式)
②写出并配平该反应的化学方程式,并用双线桥标出电子转移的方向和数目:______。
(2)铝元素是自然界中含量最多的的金属元素,应用广泛。金属铝既能与酸反应又能与强碱反应,请写出铝与强碱反应的离子方程式__________________________________________ 。
(3)Na2O2可用作呼吸面具的供氧剂, 发生反应的化学方程式为__________________________。
(4)“水玻璃”长期暴露在空气中会变质,这是因为“水玻璃”与空气中少量二氧化碳接触,生成了乳白色的凝胶状沉淀的缘故。写出反应的离子方程式_________________________________。
(5)小苏打可作胃药,请写出其中和胃酸时的离子方程式______________________ 。
(6)在反应 3BrF3+5H2O = HBrO3+Br2+9HF+O2 中,被氧化的元素是____________,当有5 mol水反应时,由H2O还原的BrF3为______________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据化学变化的实质是旧的化学键断裂、新的化学键形成这一理论,判断下列变化是化学变化的是
A.固体氯化钠溶于水B.二氧化氮溶于水
C.冰经加热变成水蒸气D.氯化氢溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定氢氧化钠的质量分数约为82%,为了验证其纯度,用浓度为0.1molL﹣1的盐酸进行滴定,完成下列问题: ①称取5.0g该氢氧化钠固体样品,配成500mL溶液备用;
②将标准盐酸装在酸式滴定管中,调节液面位置在“0”刻度以下,并记录下刻度;
③取25.00mL待测液.该项实验操作使用的主要仪器有(除锥形瓶外) , 用酚酞作指示剂时,滴定到溶液颜色由色刚好变成色为止;
④某同学根据三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000molL﹣1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理数据列出氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)= .
⑤由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是(填写编号)
A.中和滴定达终点时俯视滴定管内液面度数
B.碱式滴定管用蒸馏水洗净后立即取用25ml待测碱溶液注入锥形瓶进行滴定
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题.
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度. 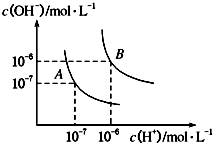
①100℃时1molL﹣1的NaOH溶液中,由水电离出的c(H+)=molL﹣1 , KW(25℃)KW(100℃)(填“>”、“<”或“=”).
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是(填“促进”、“抑制”或“不影响”).
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)c(CH3COO﹣)(填“>”、“<”或“=”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com