
【题目】化学与生活、社会发展息息相关,下列有关说法不正确的是
A.尼龙属于有机高分子材料
B.稻草秸秆和甘蔗渣中富含纤维素,可以用它来制造纸张
C.将大桥钢制构件用导线与石墨相连可以起到防腐的作用
D.刘禹锡![]() 浪淘沙
浪淘沙![]() 诗句“千淘万漉虽辛苦,吹尽黄沙始到金”中“淘”“漉”相当于“过滤”
诗句“千淘万漉虽辛苦,吹尽黄沙始到金”中“淘”“漉”相当于“过滤”
科目:高中化学 来源: 题型:
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)铬是一种硬而脆、抗腐蚀性强的金属,常用于电镀和制造特种钢。基态Cr原子中,电子占据最高能层的符号为________,该能层上具有的原子轨道数为________,电子数为________。
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能是否符合这一规律?________(填“是”或“否”),原因是_______________________________(如果前一问填“是”,此问可以不答)。
(3)镓与第ⅤA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如下图所示(白色球代表As原子)。在GaAs晶体中,每个Ga原子与________个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为________。
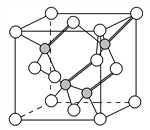
(4)与As同主族的短周期元素是N、P、AsH3中心原子杂化的类型________;一定压强下将AsH3和NH3、PH3的混合气体降温时首先液化的是________,理由是________________________。
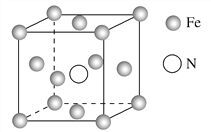
(5)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为________;设晶胞边长为a cm,阿伏加德罗常数的值为NA,该晶体的密度为________ g·cm-3(用含a和NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)的几种化合物存在下列转化关系:

已知:2CrO42-+2H+![]() Cr2O72-+H2O。下列判断不正确的是( )
Cr2O72-+H2O。下列判断不正确的是( )
A.反应①表明Cr2O3有酸性氧化物的性质
B.反应②利用了H2O2的氧化性
C.反应③中溶液颜色变化是由化学平衡移动引起的
D.反应①②③中铬元素的化合价均发生了变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是______________________________________________。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪去,有白色沉淀A产生。
① 针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:

请回答:
Ⅰ. 根据白色沉淀B是__________________(填化学式),判断沉淀A中一定存在CuSCN。
Ⅱ. 仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:_______________________________________________________。
Ⅲ. 向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是________________(填化学式)。
根据以上实验,证明A仅为CuSCN。
② 进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整:
_______Cu2+ + _______SCN![]() = _______CuSCN↓ + _______ (SCN)2
= _______CuSCN↓ + _______ (SCN)2
③ 结合上述过程以及Fe(SCN)3 Fe3+ + 3SCN![]() 的平衡,分析(2)中溶液红色褪去的原因:_________________。
的平衡,分析(2)中溶液红色褪去的原因:_________________。
(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)一I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是( )
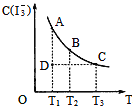
A. 反应I2(aq)+I-(aq)=I3-(aq)△H<0
B. 若温度为T1、T2反应的平衡常数分别为K1、K2,则K1>K2
C. 若反应进行到状态D时,一定有v正>v逆
D. 状态A与状态B相比,状态A的c(I2)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
A.②③B.①④
C.①③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中草药秦皮中含有七叶树内酯,其结构简式为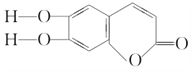 ,具有抗菌作用。若1 mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗Br2和NaOH的物质的量分别为( )
,具有抗菌作用。若1 mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗Br2和NaOH的物质的量分别为( )
A. 3 mol、2 mol B. 3 mol、3 mol C. 2 mol、2 mol D. 3 mol、4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值。下列叙述正确的是
A.0.5 mol Mg在空气中完全燃烧生成MgO和Mg3N2时,转移的电子数为NA
B.7.8 g Na2O2与足量水反应时,转移的电子数为0.2NA
C.64 g CaC2固体中所含的阴、阳离子总数为3NA
D.密闭容器中充入1 mol H2与1 mol I2反应制备HI时,生成H-I键的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ag++SCN-=AgSCN↓(白色)。实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应)。
(1)称取2.000g制备的硝酸银样品,加水溶解,定容到100 mL。溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有_________。
(2)准确量取25.00 mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.100 mol·L-1 NH4SCN标准溶液滴定。滴定终点的实验现象为_________。终点时消耗标准溶液25mL,硝酸银样品纯度为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com