
【题目】(一)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____________。
(二)工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾FeSO4·7H2O的流程如下:
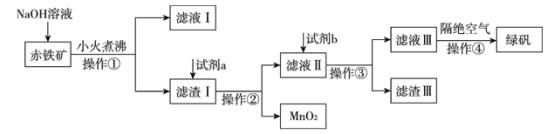
(1)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为____________;_________________。
(2)向滤渣Ⅰ中加入过量的试剂a为___________,过量的试剂b投入到滤液Ⅱ发生的所有反应的离子方程式为______________;_________________;________________。
(3)实验室中操作①②③的名称为_________________________。
(4)操作④隔绝空气的目的是_______________________________________________。
【答案】防止Fe2+被氧化2Fe2++Cl2=2Fe3++2Cl—隔绝空气(排除氧气对实验的影响)Al2O3+2OH-=2AlO2-+H2OSiO2+2OH-=SiO32-+H2O硫酸(H2SO4)Fe+2Fe3+=3Fe2+Fe+Cu2+=Cu+Fe2+Fe+2H+=H2↑+Fe2+过滤防止溶液中的Fe2+被空气氧化为Fe3+
【解析】
(一)铁和氯化铁反应生成氯化亚铁,氯化亚铁溶液中加入铁粉防止氯化亚铁被氧化;氯气具有氧化性,能氧化氯化亚铁生成氯化铁;煤油不溶于水,密度比水小,分层后可以隔离溶液与空气接触,排除氧气对实验的影响。(二)赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等),由制备流程可知,加NaOH溶液后,两性氧化物Al2O3、酸性氧化物SiO2与NaOH溶液反应,则滤液I中含有的离子为OH-、AlO2-、SiO32-,滤渣I中含Fe2O3、FeO、MnO2、CuO;加入硫酸溶液,Fe2O3、FeO、CuO溶于硫酸,得到含有硫酸、Fe2(SO4)3、FeSO4、CuSO4的混合液,则试剂a为硫酸;向混合液中加入Fe,Fe与硫酸、Fe2(SO4)3、CuSO4反应得到FeSO4溶液,则试剂b为Fe,滤渣Ⅲ为Cu、Fe,滤液Ⅲ为FeSO4溶液,FeSO4溶液经蒸发浓缩、冷却结晶得到绿矾。
(一)(1)铁和氯化铁反应生成氯化亚铁,在FeCl2溶液中需加入少量铁屑,其目的是防止氯化亚铁被氧化;(2)氯气具有氧化性能氧化氯化亚铁为氯化铁,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-;(3)煤油不溶于水,密度比水小,分层后可以隔离溶液与空气接触,排除氧气对实验的影响。(二)(1)赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等),由制备流程可知,加NaOH溶液后,两性氧化物Al2O3、酸性氧化物SiO2与NaOH溶液反应,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,,SiO2+2OH-=SiO32-+H2O。(2)试剂a为硫酸,Fe2O3、FeO、CuO溶于硫酸,得到含有硫酸、Fe2(SO4)3、FeSO4、CuSO4的混合液;试剂b为Fe,投入到滤液Ⅱ发生的所有反应的方程式为Fe+Fe2(SO4)3=3FeSO4、Fe+CuSO4=Cu+
FeSO4、Fe+H2SO4=H2↑+FeSO4。(3)实验室中操作①②③均为固液分离,操作名称为过滤。(4)FeSO4溶液在空气中,易被空气中氧气氧化,隔绝空气的目的是防止溶液中的Fe2+被空气氧化为Fe3+。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】实验室中Y形管是一种特殊的仪器,通常与其他仪器组合可以进行某些实验探究。利用下图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。回答下列问题:

(1)广口瓶中间那根玻璃管的作用是:__________________________________________。
(2)实验前需要将BaCl2溶液煮沸,其目的是:_________________________________。
(3)甲中发生反应的化学方程式为:____________________________________________。
(4)乙中分别加入一种常用氧化物和一种无色液体,常温下将两者混合可产生一种碱性气体。该反应的化学方程式为:____________________________________________。
(5)实验时,先使甲中产生的足量气体通入BaCl2溶液中,始终无沉淀生成。由此得出的结论是_______。
(6)向上述⑸实验所得溶液中通入乙产生的气体,产生白色沉淀,请写出发生反应的离子方程式:_____。
(7) 请指出该实验的一个不足之处:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物H ( )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:

已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels-Alder反应:![]() 。
。
(1)生成A的反应类型是_______。D的名称是_______。F中所含官能团的名称是_______。
(2)B的结构简式是_______;“B→C”的反应中,除C外,另外一种产物是_______。
(3)D+G→H的化学方程式是______。
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有______种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为______(任写一种)。
(5)已知:乙炔与1,3-丁二烯也能发生Diels-Alder反应。请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂合成 ,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.焰色反应为黄色,说明该物质中肯定含有钠元素
B.某物质的焰色反应不显紫色(未透过蓝色钴玻璃),说明该物质中肯定没有钾元素
C.焰色反应不能用于物质的鉴别
D.焰色反应是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同物质的量浓度的下列溶液中,①NH4Cl;②NH3·H2O;③CH3COONH4;④NH4Al(SO4)2。c(NH4+)由大到小的顺序是
A.③①④②B.④①③②C.①④③②D.④③①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)根据计算用托盘天平需称取氯化钠_________ g;
(2)配制溶液时,除需要烧杯、玻璃棒外,还必须用到的玻璃仪器有 ;
(3)配制溶液有下列几步操作:a.溶解,b.摇匀,c.洗涤,d.冷却,e.称量,f.将溶液移至容量瓶,g.定容.正确的操作顺序是 ;
(4)下列操作结果使溶液物质的量浓度偏低的是___ ______ ;
A.没有将洗涤液转入容量瓶中 |
B.加水定容时,水的量超过了刻度线 |
C.定容时,俯视容量瓶的刻度线 |
D.容量瓶洗涤后,未经干燥处理 |
(5)取出该NaCl溶液10mL加水稀释到200mL,稀释后溶液中NaCl的物质的量浓度是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H-H键、Cl-Cl键和H-Cl键的键能分别为436kJ·mol-1、243kJ·mol-1和431kJ·mol-1,则由Cl2(g)和H2(g)反应生成1molHCl(g)时的能量变化是:
A. 放热183kJ B. 放热91.5kJ C. 吸热183kJ D. 吸热91.5kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,溶液中由水电离出氢离子的浓度为1×10-12mol·L-1,下列说法正确的是( )
A.该溶液pH=12B.该溶液pH=2
C.该溶液pH=12或2D.不能确定溶液pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)![]() 2C(g)+ D(g),经2minB的浓度减少0.6mol/L。对此反应速率的表示正确的是
2C(g)+ D(g),经2minB的浓度减少0.6mol/L。对此反应速率的表示正确的是
A. 用A表示的反应速率是0.4 mol/(L·min)
B. 分别用B、C、D表示的反应速率其比值是3:2:1
C. 在2min末的反应速率,用B表示是0.3mol/(L·min)
D. 在这2min内用B和C表示的反应速率的值都是逐渐减小的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com