
【题目】某温度下,浓度都是1 mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得各物质的浓度分别为c(X2)=0.4 mol/L,c(Y2)=0.6 mol/L,c(Z2)=0.4 mol/L,则该反应的化学方程式可表示为
A.2X2+3Y2![]() 2X2Y3B.3X2+2Y2
2X2Y3B.3X2+2Y2![]() 2X3Y2
2X3Y2
C.X2+2Y2![]() 2XY2D.2X2+Y2
2XY2D.2X2+Y2![]() 2X2Y
2X2Y
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数的值,下列叙述中正确的是( )
表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.常温常压下,20g![]() 和足量的金属钠反应产生气体的分子数为
和足量的金属钠反应产生气体的分子数为![]()
B.1mol![]() 与足量的水反应,转移的电子数为
与足量的水反应,转移的电子数为![]()
C.![]() 个
个![]() 分子在标准状况下的体积为
分子在标准状况下的体积为![]() L
L
D.![]() 时,
时,![]() 的
的![]() L
L![]() 溶液中含有的
溶液中含有的![]() 数目为
数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代《天工开物》记载了“火法”冶炼锌的方法:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷淀,毁罐取出,…,即倭铅也”,现代工业开发了用NH3—NH4Cl水溶液浸出氧化锌烟灰(主要成分为ZnO 、少量Pb、CuO和As2O3)制取高纯锌的工艺流程如图所示。
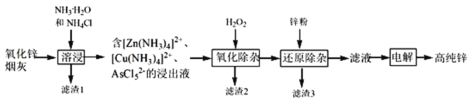
请回答下列问题:
(1)《天工开物》中炼锌的方法中“泥封”的目的是____________。
(2)滤渣1的主要成份分别是_______(填化学式),“过滤”用到的玻璃仪器是__________。
(3) “溶浸”时,氧化铜参与反应的相关离子方程式是________;“溶浸”时可以适当升高温度,但不宜过高,其原因是________________。
(4) “氧化除杂”的目的是将AsCl52-转化为As2O5胶体,再经吸附聚沉除去,溶液始终接近中性,该反应的离子方程式是_____________________。
(5) “电解”含 [Zn(NH3)4]2+的溶液,阴极放电的电极反应式是_________。阳极区产生一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是_______(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得诺贝尔化学奖。轮烷是一种分子机器的“轮子”,芳香化合物a、b、c是合成轮烷的三种原料,其结构如下图所示。下列说法不正确的是

A. b、c互为同分异构体
B. a、c分子中所有碳原子均有可能处于同一平面上
C. a、b、c均能发生氧化反应、加成反应、加聚反应和酯化反应
D. a、b、c均能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=lgKa,25℃时,H2SeO3 的 pKa1=1.34, pKa2=7.34。用 0.1molL1NaOH 溶 液滴定 20mL0.1molL1H2SeO3 溶液的滴定曲线如图所示(曲线上的数字为 pH)。下列说法不正 确的是

A. a 点所得溶液中:2c(H2SeO3)+c(SeO32)<0.1 molL1
B. b 点所得溶液中:c(H2SeO3)+c(H+)=c(SeO32)+c(OH)
C. c 点所得溶液中:c(Na+)<3c(HSeO3)
D. d 点所得溶液中:c(Na+)>c(SeO3)>c(HSeO3 )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香羧酸通常用芳香烃的氧化来制备,某同学用甲苯的氧化反应制备苯甲酸。已知:![]() +2KMnO4
+2KMnO4![]() +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
反应试剂、产物的物理常数:
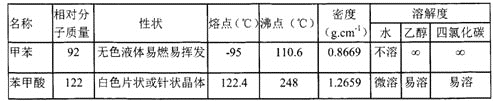
主要实验装置和流程如下:
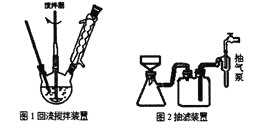
实验方法:向图1装置中依次加入2.8mL甲苯、200mL水和8.6g高锰酸钾,通冷凝水,加热至沸腾,在反应过程中,甲苯不断的被冷凝回流,反应结束后,按以下步骤操作,得到苯甲酸粗产品。
![]()
(1)图1装置中反应结束的标志是__,趁热抽滤的目的是__。
(2)写出浓盐酸酸化时的所有离子反应方程式__。
(3)下列说法正确的是__。
A.图1装置中的反应混合物抽滤时应用玻璃砂漏斗替代布氏漏斗
B.在冷却抽滤时,若有产品黏在瓶壁上,可用滤液淋洗,直到所有晶体收集到布氏漏斗中,再次抽滤
C.苯甲酸粗产品的杂质除KCl外还可能含有甲苯,均可用蒸馏水洗涤除去
D.抽滤结束,为防止倒吸,应先关闭水龙头,再拆掉抽气泵和吸滤瓶之间的橡皮管
(4)苯甲酸纯度测定:用__(填仪器名称)称取1.220g产品,加合适溶剂溶解,再用蒸馏水稀释配成100mL溶液,取25.00mL溶液,滴加几滴指示剂,用0.1000molL-1NaOH标准液进行滴定,平行滴定3次,平均消耗标准液体积为21.00mL
①“合适溶剂”和“指示剂”分别为__。
A.蒸馏水和酚酞 B.乙醇和甲基橙 C.四氯化碳和酚酞 D.乙醇和酚酞
②苯甲酸产品的纯度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
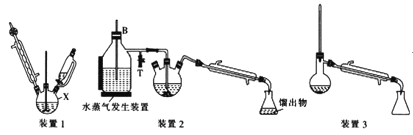
【题目】苯胺(又名氨基苯)是最重要的胺类物质之一,可作为炸药中的稳定剂、汽油中的防爆剂,也可作为医药磺胺药的原料等。苯胺为无色油状液体,有特殊气味,可用水蒸气蒸馏提纯。用纳米铁粉还原硝基苯制备苯胺的原理及装置图(略去夹持装置和加热装置)如下:
4![]() +9Fe+4H2O
+9Fe+4H2O![]() 4
4![]() +3Fe3O4
+3Fe3O4
已知部分有机物的一些数据如下表:
名称 | 密度(gmL-1) | 熔点(℃) | 沸点(℃) | 溶解性 | 备注 |
硝基苯 | 1.2037 | 5.7 | 210.8 | 难溶于水,易溶于乙醇、乙醚 | |
苯胺 | 1.0217 | -6.3 | 184.4 | 难溶于水,易溶于乙醇、乙醚 | 空气中易变质 |
乙醚 | 0.7134 | -116.3 | 34.6 | 微溶于水,易溶于乙醇 |
Ⅰ.合成:在装置1中的仪器X中,加入9g纳米铁粉、20mL水、1mL冰醋酸,加热至煮沸,煮沸3~5min后冷却至室温,再将7.0mL硝基苯逐滴加入(该反应强烈放热),搅拌、加热、回流半小时,至反应完全。
Ⅱ.分离提纯:将装置1改为装置2进行水蒸气蒸馏,取装置2中的馏出物约5~6mL,转移至分液漏斗中,分离出有机层后,水层加入1.3gNaCl固体,用乙醚萃取3次(每次用7.0mL乙醚),合并有机层和乙醚萃取液,加入粒状NaOH干燥,过滤后转移至干燥的圆底烧瓶中,水浴蒸去乙醚,残留物再利用装置3蒸馏并收集温度T℃时的馏分。
请回答下列问题:
(1)由苯制取硝基苯的化学方程式为__。
(2)仪器X的名称是__;加入硝基苯时,“逐滴加入span>”的目的是__。
(3)分离提纯过程中加入NaCl固体的作用是__。
(4)装置2和装置3都需要通冷凝水,冷凝水的作用是__;装置2中长导管B的作用是__。
(5)萃取分液操作过程中要远离明火和热源,原因是__。
(6)温度T的范围为__,实验结束得到6.0mL产物,则苯胺的产率为__(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:![]() 。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4
。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4![]() 、0.2
、0.2![]() 、0.4
、0.4![]() ,当反应达到平衡时,可能存在的数据是( )
,当反应达到平衡时,可能存在的数据是( )
A. SO2的浓度为0.8![]() ,O2为0.4
,O2为0.4![]() B. SO2的浓度为0.5
B. SO2的浓度为0.5![]()
C. SO3的浓度为0.8![]() D. SO2、SO3的浓度一定均为0.3
D. SO2、SO3的浓度一定均为0.3![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
①晶体中分子间作用力越大, 分子越稳定
②原子晶体中共价键越强, 熔点越高
③干冰是 CO2 分子通过氢键和分子间作用力有规则排列成的分子晶体
④在Na2O和Na2O2晶体中,阴、阳离子数之比相等
⑤正四面体构型的分子,键角都是109°28',其晶体类型可能是原子晶体或分子晶体
⑥分子晶体中都含有化学键
⑦含4.8 g碳元素的金刚石晶体中的碳碳键的物质的量为0.8 mol
A.①②③④⑤B.②④⑦C.⑤⑥⑦D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com