
����Ŀ�������й�˵����ȷ�ҽ��ͺ�������
˵�� | ���� | |
A | һ���¶�ѹǿ�£�2 g H2 �� 4 g H2 ��ȫȼ�գ����� ȼ���ȵ���ֵ�� | 4 g H2 �ų������� |
B | 2SO2(g)��O2(g) ƽ����ټ��� SO2��Q ���� | ƽ�����ƣ��ų��������� |
C | ������ʵ���Ũ�ȵ� NaI �� KBr ���Һ�еμ� AgNO3 ��Һ�������ɻ�ɫ AgI ���� | Ksp(AgI)��Ksp(AgBr) |
D | �����ʵ���Ũ�� Na2CO3 �� pH ���� CH3COONa | H2CO3 �����Ա� CH3COOH ǿ |
A.AB.BC.CD.D
���𰸡�C
��������
A. ������������Խ��ȼ�շų���������Խ�࣬4 g H2 �ų������ࣻ��ȼ����ָ����1mol��ȼ����ȫȼ�������ȶ���������ʱ�ų���������һ���¶�ѹǿ�£�������ȼ���ȵ���ֵ�Ǹ���ֵ��A������
B. ��һ����Ӧȷ���Ժ����÷�Ӧ�ġ�H�Ͳ��ٷ����仯��������Ӧ��ƽ����ټ��� SO2��ƽ�����ƣ��ų��������������ǡ�H������B������
C. ������ʵ���Ũ�ȵ� NaI �� KBr���Һ�еμ�AgNO3 ��Һ�������ɻ�ɫ AgI ������˵�������Ӻ��������ȷ�����Ӧ���ɸ����ܵij�����Ksp(AgI)��С������Ksp(AgI)��Ksp(AgBr)��C��ȷ��
D. �����ʵ���Ũ�� Na2CO3 �� pH ���� CH3COONa��˵��Na2CO3��ˮ����������CH3COONa��ˮ������������Խ��Խˮ��Ĺ��ɿ�֪���γɸ��ε���Խ������ˮ��������Խǿ����������H2CO3 �����Ա� CH3COOH ����D������
��������������ѡC��


 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
��1����ҵ�ϳ���������ұ����������
�����������Ҫ�ɷ�Ϊ![]() ��
��![]() ������
������![]() ����____________������ԡ������ԡ������ԡ��������
����____________������ԡ������ԡ������ԡ��������
��ұ����������Ҫ�õ�����������ˮ������Һ��____________������ԡ����ԡ�����
�����ý�����ԵIJ�ͬ�����Բ��ò�ͬ��ұ����������ȡ������Ӧ��ȡ_____________����Ȼ�ԭ������ⷨ������
��2����ҵ�Ϻϳɰ��ķ�ӦΪ��![]() ��һ�������£���
��һ�������£���![]() ��
��![]() ����
����![]() ���ܱ������У�
���ܱ������У�![]() ����
����![]() Ϊ
Ϊ![]() ��
��
����![]() ��ʾ�÷�Ӧ������Ϊ___________��
��ʾ�÷�Ӧ������Ϊ___________��
��������������ʱ����ͨ��![]() ���÷�Ӧ�����ʽ�_____________�������С������
���÷�Ӧ�����ʽ�_____________�������С������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ֳ�Ӳ��ĥͿ����ϡ���ͼΪ�侧��ṹ����С���ظ��ṹ��Ԫ�����е�ÿ��ԭ�Ӿ�����8�����ȶ��ṹ�������й�˵����ȷ����( )
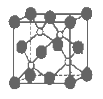
A.������Ļ�ѧʽΪBP���������Ӿ���
B.��������۵�ߣ�������״̬���ܵ���
C.��������ÿ��ԭ�Ӿ��γ�4�����ۼ�
D.������ṹ���Ŀռ�ѻ���ʽ���Ȼ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᣨHCOOH����һ�ֳ�����һԪ���ᣬ��ˮ��Һ�д������µ���ƽ�⣺HCOOH![]() H++HCOO-�������й�˵������ȷ����
H++HCOO-�������й�˵������ȷ����
A.�ڸ���Һ�У�c(H+)�Դ���c(HCOO��)
B.�����Һ�м���NaOH���壬����ƽ�������ƶ���pHֵ����
C.���Ȼ�������ͨ����Һ�У�ƽ�������ƶ���c(HCOO��)����
D.����Һ��ˮϡ�ͣ�c(OH��)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���廪��ѧ�����ս����״����ҵ�ⷨ�Ʊ�LiOH���乤��ԭ����ͼ��ʾ������˵������ȷ���ǣ�������

A.X�缫���ӵ�Դ����
B.MΪ�����ӽ���Ĥ
C.Y�缫��ӦʽΪ![]()
D.�Ʊ�2.4gLiOH������H2�ڱ�״����Ϊ1.12L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ӷ���ʽ��ȷ���ǣ� ��
A.ϡ�����������м��Ӧ��Fe+4H++NO3-=Fe3++NO��+2H2O
B.��Ca(
HCO3)
2��Һ�м������NaOH��Һ��Ca2++2HCO3-+2OH-=CaCO3��+CO32-+2H2O
C.̼��������Һˮ������ӷ���ʽ��HCO3��+H2O![]() CO32��+H3O+
CO32��+H3O+
D.Fe(OH)3�����������Fe(OH)3+3H+=Fe3++3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʵ���벻��ˮ�������ˮ�IJ�ͬ���ú��ܣ����������ĸ�װ��ͼ���ش����⣺
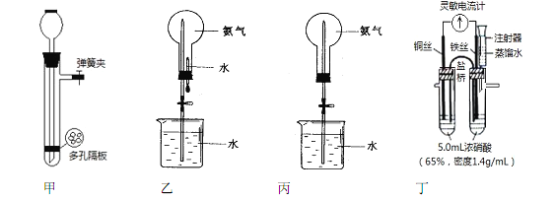
ʵ��һ����ȡ����
��1��ͼ����ʾװ�ÿ�����ʵ������ȡ��������������װ���ڼ��뷴Ӧ��ǰ����μ��������______��
��2����п��ϡ������ȡ����ʱ��������������ͭ��Һ��ӿ�������������ʣ�����ͼӿ췴Ӧ���ʵ�ԭ��________________________________��
ʵ�������Ȫʵ��
��3��ͼ����ʾװ������ƿ��װ�����ﰱ���� ������Ȫʵ��ʱӦ����___________����������ͷ�ι���������ֹˮ��������
��4�����ֻ�ṩ��ͼ����ʾװ�ã�����Ѹ��������Ȫ�����з������е���____________��
a������ë����ס��ƿ
b���ñ�����ס��ƿ
c�����ձ��е�ˮ���ɱ���ʳ��ˮ
d�����ձ��м�����������
ʵ������̽��һ���¶�����ʹ���ۻ�����������Ũ�ȣ�ʵ��װ����ͼ����ʾ��
����ʼʵ��ʱ���۲쵽����������ָ��ָ��ͭ˿������Ѹ�ٷ�תָ����˿��
������ʢ����ˮ��ע�����������֧�Թ��ڼ�ˮ������ָ��ǡ�ÿ�ʼ��תָ��ͭ˿ʱֹͣʵ�飻
���ظ�����ʵ���ƽ����ˮ��Ϊ2.5 mL��ˮ���ܶȰ�1.0g/mL���㣩��
��5����ʵ��װ�õIJ���֮����__________________________________��
��6����ָ���һ��ָ��ͭ˿ʱ�������ĵ缫��ӦʽΪ_______________________________��
��7�����ݴ�ʵ����㣬ʹ���ۻ������������������Ϊ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����20 mL 0.1 mol��L��1һԪ����HA��Һ�еμ�0. 1 mol�� L��1 NaOH��Һ����Һ��1g[c(A-)/c(HA)]��pH��ϵ��ͼ��ʾ������˵����ȷ����

A. A���Ӧ��Һ�У�c(Na+)��c(A-)��c(H+)��c(OH-)
B. 25��ʱ��HA��ĵ��볣��Ϊ1. 0�� 10��5.3
C. B���Ӧ��NaOH��Һ���Ϊ10 mL
D. ��C����Һ����(�����ǻӷ�)����c(A-)/[c(HA)c(OH-)]һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2C2O4�Ƕ�Ԫ���ᣬ�����£�Ka1(H2C2O4)=5.4��10-2��Ka2(H2C2O4)=5.4��10-5��������Һ������Ũ�ȹ�ϵʽ��ȷ���ǣ� ��
A.pH=2��H2C2O4��Һ�У�c(H+)=c(HC2O4-)=10-2molL-1
B.pH=2��H2C2O4��Һ��pH=12��NaOH��Һ���������ϣ�c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
C.��NaOH��Һ�μӵ�H2C2O4��Һ���������Һ�����ԣ�c(C2O42-)��c(HC2O4-)
D.NaHC2O4��Һ�У�c(Na+)��c(HC2O4-)��c(H2C2O4)��c(C2O42-)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com