
【题目】溴是一种重的化工原料,从淡化海水中提取溴的工艺流程如下:
![]()
⑴操作Ⅱ中,用饱和Na2CO3碱性溶液吸收Br2,过程中有CO2产生,反应的粒子方程式为______,当0.6 mol Br2被吸收时,转移电子的数目为______
![]() 步骤Ⅳ包含萃取,分液和蒸馏,该过程中不必用到的仪器有______
步骤Ⅳ包含萃取,分液和蒸馏,该过程中不必用到的仪器有______![]() 填序号
填序号![]()
a.烧杯 b.分液漏斗c.普通漏斗 d.玻璃棒 e.蒸发皿 f.冷凝管
![]() 某化学兴趣小组利用高锰酸钾和浓盐酸反应制取氯气,并探究氯水的性质
某化学兴趣小组利用高锰酸钾和浓盐酸反应制取氯气,并探究氯水的性质
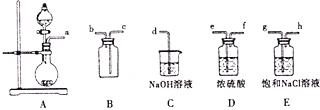
①将A,B,C相连,制得Cl2后加入适量水,即可制得氯水,将所得氯水分为两份,进行甲,乙两个实验,实验操作如下,将现象填入下表:
实验序号 | 实验操作 | 现象 |
甲 | 将氯水滴入品红溶液 | ______ |
乙 | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 |
②由实验乙不能推出氯气与水反应的产物具有酸性,原因是______,若要制备纯净干燥的Cl2,按气流方向连接各仪器接口,顺序为a→_____→_____→_____→_____→_____→_____→d
![]() 实验完毕后,假设装置C中氢氧化钠和
实验完毕后,假设装置C中氢氧化钠和![]() 恰好完全反应,其反应方程式为______,反应后溶液中离子浓度由大到小的顺序为______,常温下HClO的电离平衡常数为K,则常温下NaClO水解反应的平衡常数为______(用含Ka和Kw的表达式表示)
恰好完全反应,其反应方程式为______,反应后溶液中离子浓度由大到小的顺序为______,常温下HClO的电离平衡常数为K,则常温下NaClO水解反应的平衡常数为______(用含Ka和Kw的表达式表示)
【答案】Br2 + CO32-+4OH- = 5Br-+ BrO3-+ CO2↑ + 2H2O 6.02×1023 cde 溶液褪色 新制取的氯气中含HCl气体,也能与碳酸钠溶液反应产生气泡 g h e f c b Cl2 + 2NaOH =NaClO + NaCl +H2O c(Na+) >c(Cl-) > c(ClO-) > c(OH-) > c(H+) ![]()
【解析】
⑴根据用饱和Na2CO3碱性溶液吸收Br2,生成溴化钠和溴酸钠,同时有CO2放出写出离子方程式,再根据氧化有还原反应电子转移得出答案。
⑵根据萃取、分液,蒸馏步骤所用的仪器得出。
⑶①氯气和水反应生成HClO具有漂白性;②新制取的氯气中含HCl气体,也能与碳酸钠溶液反应产生气泡,因此除去氯化氢和水。
③氯气和氢氧化钠反应产生氯化钠、次氯酸钠和水,写出反应方程式,氯化钠和次氯酸的物质的量相等,次氯酸钠水解生成次氯酸和氢氧根离子,溶液呈碱性,再比较离子浓度大小,常温下NaClO水解反应的平衡常数与HClO电离平衡常数和离子积关系。
⑴由图可知,操作Ⅱ中,用饱和Na2CO3碱性溶液吸收Br2,生成溴化钠和溴酸钠,同时有CO2放出,离子方程式为:3Br2 + CO32-+4OH- = 5Br-+ BrO3-+ CO2↑+ 2H2O,由离子方程式可知3个Br2转移5个电子,当0.6 mol Br2被吸收时,转移电子为1mol,即数目为6.02×1023个,故答案为:3Br2 + CO32-+4OH- = 5Br-+ BrO3-+ CO2↑+ 2H2O;6.02×1023。
⑵萃取、分液必须用到的仪器是分液漏斗,烧杯,蒸馏中用到蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶等,所以步骤Ⅳ包含萃取,分液和蒸馏,该过程中不必用到的仪器有普通漏斗、玻璃棒、蒸发皿;故选:cde。
⑶①氯气和水反应生成HClO具有漂白性,将氯水滴入品红溶液,溶液褪色,故答案为:溶液褪色。
②新制取的氯气中含HCl气体,也能与碳酸钠溶液反应产生气泡;若要制备纯净干燥的Cl2,必须除去氯化氢和水,先通过饱和氯化钠溶液除去氯化氢,再通过浓硫酸除去水,最后通过长进短出收集气体,所以若要制备纯净干燥的Cl2,按气流方向连接各仪器接口,顺序为aghefcb,故答案为:新制取的氯气中含HCl气体,也能与碳酸钠溶液反应产生气泡;ghefcb。
③氯气和氢氧化钠反应产生氯化钠、次氯酸钠和水,方程式为:Cl2 + 2NaOH =NaClO + NaCl +H2O;恰好完全反应时氯化钠和次氯酸的物质的量相等,次氯酸钠水解生成次氯酸和氢氧根离子,溶液呈碱性,离子浓度大小顺序为:c(Na+) >c(Cl-) > c(ClO-) > c(OH-) > c(H+),常温下NaClO水解反应的平衡常数![]() ;故答案为:Cl2 + 2NaOH =NaClO + NaCl +H2O;c(Na+) >c(Cl-) > c(ClO-) > c(OH-) > c(H+);
;故答案为:Cl2 + 2NaOH =NaClO + NaCl +H2O;c(Na+) >c(Cl-) > c(ClO-) > c(OH-) > c(H+);![]() 。
。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】CaC2和MgC2都是离子化合物,下列叙述正确的是( )
①CaC2和MgC2都跟水反应生成乙炔
②C![]() 的电子式为
的电子式为![]()
③CaC2在水中以Ca2+和C![]() 形式存在
形式存在
④MgC2的熔点低,可能在100℃以下
A.①②B.②④C.①③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①Cl2 ②Na2O2 ③NaOH ④HCl ⑤H2O2 ⑥MgF2 ⑦NH4Cl
(1)只由非极性键构成的物质是___(填编号,下同);
(2)由离子键和极性键构成的物质是___;
(3)属于共价化合物的物质是___;
(4)⑤H2O2的电子式为:___;
(5)用电子式表示⑥MgF2的形成过程:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图Ⅱ表示常温下,0.100 mol/L NaOH溶液滴定20.00 mL、0.100 mol/L HC1溶液所得到的滴定曲线。
C.图Ⅲ表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c<a<b
D.图Ⅳ表示反应4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a
N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是( )
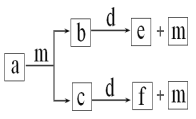
A.简单离子半径:Z<Y
B.简单气态氢化物的热稳定性:Y>X
C.阴离子的还原性:Y>W
D.W2Y2中含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预言自然界中可能存在原子序数为114号的稳定同位素![]() X,根据原子结构理论和元素周期律下列预测错误的是
X,根据原子结构理论和元素周期律下列预测错误的是
A.![]() X位于第七周期,第ⅣA 族B.X是金属元素
X位于第七周期,第ⅣA 族B.X是金属元素
C.XO2是酸性氧化物D.X元素的化合价有+2和+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)如图是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图。
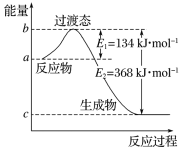
请写出NO2和CO反应的热化学方程式:___。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知:③H2O(g)=H2O(l) ΔH=-44kJ·mol-1
则甲醇蒸气完全燃烧生成液态水的热化学方程式:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=___。
O2(g)=CO2(g)+2H2O(l) ΔH=___。
(3)CO2是一种廉价的碳资源,其综合利用具有重要意义。CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___(写离子符号);若所得溶液c(HCO3)∶c(CO32)=2∶1,溶液pH=___。(室温下,H2CO3的K1=4×107;K2=5×1011)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯仿(CHCl3)可用作麻醉剂,但常因保存不慎,而被空气中的氧气氧化,生成剧毒的光气(COCl2),发生反应的化学方程式为2CHCl3+O2![]() 2HCl+2COCl2,为防止发生事故,在使用前要检验氯仿是否变质,应选用的试剂是( )
2HCl+2COCl2,为防止发生事故,在使用前要检验氯仿是否变质,应选用的试剂是( )
A. 氢氧化钠溶液 B. 硝酸银溶液 C. 溴水 D. 淀粉碘化钾试剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是___(填编号)。若测定结果偏高其原因可能是__(填字母)。
A.配制标准溶液的固体NaOH中混有Na2O杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后再用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是___。
(3)如图是某次滴定时滴定管中的液面,其读数为___mL。
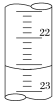
(4)根据下列数据,请计算待测盐酸的浓度:___molL-1。
滴定次数 | 待测体积(mL) | 标准NaOH溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com