
【题目】合成氨化学方程式 N2(g)+3H2(g)![]() 2NH3(g) △H=92.4 kJ/mol。将l mol N2(g)、3 mol H2(g)充入2 L的密闭容器中,在500℃下反应,10 min 时达到平衡,NH3的体积分数为
2NH3(g) △H=92.4 kJ/mol。将l mol N2(g)、3 mol H2(g)充入2 L的密闭容器中,在500℃下反应,10 min 时达到平衡,NH3的体积分数为![]() ,下列说法中正确的是
,下列说法中正确的是

A. 若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图甲所示
B. 反应过程中,混合气体平均相对分子质最M,混合气体密度d,混合气体压强p,三者关系如图乙所示
C. 图丙容器I和II达到平衡时,NH3的体积分数![]() ,则容器I放出热量与容器II吸收热量之和为92.4 kJ
,则容器I放出热量与容器II吸收热量之和为92.4 kJ
D. 若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
【答案】B
【解析】
试题A、达到平衡时放出的热量为9.24kJ,由热化学方程式可知参加反应的氢气的物质的量为0.3mol,10min内氢气的平均速率为0.015mol/(Lmin),反应速率应为由高到低,A错误;B、混合气体的总质量不变,容器的体积不变,混合气体的密度为定值;随反应进行、混合气体的物质的量减小,混合气体的平均相对分子质量增大、混合气体的压强降低,B错误;C、恒温恒容下,容器Ⅱ中按化学计量数转化为N2、H2,可得N21mol、H23mol,容器Ⅰ、容器Ⅱ内为等效平衡。平衡时容器内对应各物质物质的量相等,容器I放出热量与容器II吸收热量之和为92.4kJ,C正确;D、增大压强平衡向正反应方向移动,氨气的体积分数增大,升高温度平衡向逆反应方向移动,平衡时NH3的体积分数减小,D错误,答案选C。


科目:高中化学 来源: 题型:
【题目】某反应过程中体系的能量变化如图所示,下列说法错误的是
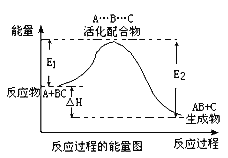
A. 该反应不一定能自发进行
B. E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能
C. 正反应的热效应为△H=E1-E2,且E2>E1,所以正反应为放热反应
D. 加入合适催化剂,△H不变,E1、E2也不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分子式为C5H10、核磁共振氢谱中只有一个峰的烃的结构简式_______;
(2)①分子式为C7H8的芳香烃与浓硝酸反应的化学方程式____________________________,②环己烯与溴的四氯化碳溶液反应的化学方程式_________________________________;
(3)用系统命名法命名
①![]() 名称:_________________。
名称:_________________。
② 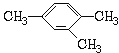 名称:_________________。
名称:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用密度为1.84g·mLˉ1、质量分数为98%的浓硫酸配制100mL3mol·Lˉ1稀硫酸。下列各步骤中操作正确的是( )
A.计算、量取:用10mL量筒量取16.3mL浓硫酸
B.溶解、稀释:将浓硫酸倒入烧杯,再倒入30mL左右的蒸馏水,搅拌,静置
C.转移、洗涤:待溶液冷却后,将溶液转移到容量瓶中,用蒸馏水洗涤烧杯和玻璃棒,洗涤液转入容量瓶,重复2~3次
D.定容、摇匀:加水至凹液面最低处与刻度线相切,摇匀,在容量瓶上贴上标签,注明溶液成分及浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 已知2C(s)+2O2(g) == 2CO2(g) ΔH1, 2C(s)+O2(g)==2CO(g) ΔH2,则ΔH1<ΔH2
C. 已知H+(aq)+OH-(aq) == H2O(l) ΔH=-57.3kJ·mol-1,则任何酸碱中和反应的热效应数值均为57.3kJ
D. 已知C(石墨,s) == C(金刚石,s) ΔH>0,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某化工厂提供的硒酸泥(主要含S、Se、Fe2O3及SiO2)中提取粗硒的工艺流程如下图所示:

备注:氧化浸出液中Se的含量为43.45g/L
根据以上信息回答下列问题:
(1)把煤油加热后再进行浸泡的目的是:__________________________。
(2)将含硫的滤液进行“冷却、结晶、过滤”操作可以除去煤油中的硫,由这一操作可推测硫的物理性质是:__________________________。
(3)“氧化浸硒”过程中:
①需要控制H2SO4的浓度至少为3mol/L,理由是:__________________________。
②硒转化为H2SeO3并生成一种黄绿色的气体,此过程的化学方程式为_______________。
(4)要将1L氧化浸出液中的硒元素全部还原,需要至少加入Na2SO3_____mol;
(5)滤渣A的主要成分有___________;滤液B的金属阳离子有___________;
(6)处理硒酸泥的另一种方法是往硒酸泥中加入等体积的浓硫酸进行焙烧,本工艺流程与此方法相比主要的优点是(写两点):__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,向某VL的密闭容器中充入3molH2(g)和3molI2(g),发生反应:H2(g)+I2(g)![]() 2HI(g) △H=-26.5kJmol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。请回答下列问题:
2HI(g) △H=-26.5kJmol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。请回答下列问题:

(1)0-5秒内平均反应速率v(HI)=___mol/(Ls)。
(2)该反应达到平衡状态时,放出的热量为___kJ。
(3)判断该反应达到平衡的依据是___(填序号)。
①H2消耗的速率和I2消耗的速率相等
②H2、I2、HI的浓度比为1:1:2
③H2、I2、HI的浓度都不再发生变化
④该条件下正、逆反应速率都为零
⑤混合气体的平均分子量不再发生变化
⑥气体的颜色不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在学习元素化合物知识的过程中,发现含有相同元素的物质间在一定条件下存在转化规律,绘制出如下转化关系图(部分反应物或产物略去),并用于研究物质A、B、C、D的性质及其变化。
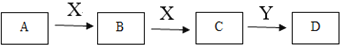
(1)若A是黄绿色气体,X是生活中应用最大量的金属,D是白色固体。
① 组成A的元素在周期表中的位置是______。
② 下列说法正确的是______(填字母)。
a.B的水溶液中加入KSCN溶液,变为红色
b.C只具有还原性
c.若Y是碱,D放置在空气中会迅速变为灰绿色,最终变为红褐色
(2)若A、B、C、D的焰色反应均为黄色,X的固体俗称干冰。
① B转化为C的离子方程式是______。
② A用于呼吸面具或潜水艇中氧气的来源,则A和X反应生成1 mol B时,转移电子数为______。
③ C与Y反应生成X的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将 2 molSO2 和 1 molO2 充入一定容密闭容器中,在催化剂存在下进行下列反应: 2SO2(g)+O2(g)![]() 2SO3(g);△H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
2SO3(g);△H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
A. 生成 SO3为2 mol
B. 反应放出 197 kJ 的热量
C. SO2和SO3 物质的量之和一定为 2mol
D. SO2、O2、SO3的物质的量之比一定为2:1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com